
 硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:
硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:| 化学键 | N≡N | H-H | N-H |
| 键能/kJ/mol | a | b | c |
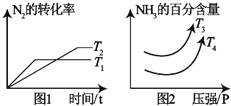
分析 (1)①看图1根据“先拐先平数值大”的原则判定T1>T2,由T2到T1是升温过程,升高温度导致N2的转化率减小,平衡逆向移动,则逆反应为吸热反应,正反应为放热反应,△H1<0;看图2先固定某一横坐标不变,由T4到T3,NH3的百分含量增大,说明平衡正向移动,正反应为放热反应;
②对该过程列“起、转、平”得:
N2(g)+3H2(g)?2NH3(g)
起始物质的量:2 6 0
转化物质的量:x 3x 2x
平衡物质的量:2-x 6-3x 2x
根据平衡时“NH3的体积分数为60%”列等式为:$\frac{2x}{2-x+6-3x+2x}$×100%=60%,则x=1.5,
结合v=$\frac{△c}{△t}$、转化率=$\frac{转化的量}{开始的量}$×100%、恒温恒容时压强之比等与气体的物质的量之比、K为生成物浓度幂之积与反应物浓度幂之积的比;升高温度平衡逆向移动;
③再次加入1mol N2和3mol H2,相当于加压,平衡正向移动;
④根据Qc和K值的相对大小可以判定平衡移动方向,Qc=$\frac{{1}^{2}}{1×{1}^{3}}$,Qc<K,平衡正向移动,V正>V逆.增大一种反应物浓度,会使另一种反应物转化率增大;
⑤加压速率加快且正向移动H2转化率增大.增大N2浓度,导致反应物浓度增大速率加快,且平衡正向移动;
(2)反应热等于反应物断键吸收能量与生成物成键放热能量之差,反应吸放热与产物的物质的量成正比;
(3)由①N2(g)+3H2(g)═2NH3(g)△H1kJ/mol
②4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H2kJ/mol
③4NO(g)+3O2(g)+2H2O(g)═4HNO3(aq)△H3kJ/mol
结合盖斯定律可知(①式×2+②式+③式)÷2即可得N2(g)+3H2(g)+4O2(g)═2HNO3(aq)+2H2O(l).
解答 解:(1)①看图1根据“先拐先平数值大”的原则判定T1>T2,由T2到T1是升温过程,升高温度导致N2的转化率减小,平衡逆向移动,则逆反应为吸热反应,正反应为放热反应,△H1<0;看图2先固定某一横坐标不变,由T4到T3,NH3的百分含量增大,说明平衡正向移动,正反应为放热反应,故采取措施为降低温度,则T3<T4,故答案为:<;<;
②对该过程列“起、转、平”得:
N2(g)+3H2(g)?2NH3(g)
起始物质的量:2 6 0
转化物质的量:x 3x 2x
平衡物质的量:2-x 6-3x 2x
根据平衡时“NH3的体积分数为60%”列等式为:$\frac{2x}{2-x+6-3x+2x}$×100%=60%,则x=1.5,
故0到10min内用H2表示化学反应速率为$\frac{\frac{4.5mol}{2L}}{10min}$=0.225mol/(L•min),N2的转化率为$\frac{1.5mol}{2mol}$×100%=75%;
根据恒温恒容时,压强之比等与气体的物质的量之比,故反应开始和平衡状态体系的压强之比等于(2+6):(0.5+1.5+3)=8:5;
由平衡时浓度可知平衡常数K=$\frac{1.{5}^{2}}{0.25×0.7{5}^{3}}$=21.3,升高温度平衡逆向移动,导致生成物浓度减小,反应物浓度增大,K的分子变小,分母变大,K值减小,
故答案为:0.225;75%;8:5;21.3;减小;
③再次加入1mol N2和3mol H2,相当于加压,平衡正向移动,H2转化率增大,
故答案为:增大;
④Qc=$\frac{{1}^{2}}{1×{1}^{3}}$=1,Qc<K,平衡正向移动,V正>V逆.增大一种反应物浓度,会使另一种反应物转化率增大,自身转化率减小,故答案为:>; 降低;
⑤加压速率加快且正向移动H2转化率增大.增大N2浓度,导致反应物浓度增大速率加快,且平衡正向移动H2转化率增大,
故答案为:增大压强和增大N2浓度;
(2)由表格中数据及N2(g)+3H2(g)?2NH3(g)可知△H1=(a+3b-6c)kJ/mol,焓变为负,由反应吸放热与产物的物质的量成正比得:$\frac{2}{6c-a-3b}=\frac{3}{x}$,解得x=9c-1.5a-4.5b,
故答案为:(a+3b-6c);9c-1.5a-4.5b;
(3)由①N2(g)+3H2(g)═2NH3(g)△H1kJ/mol
②4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H2kJ/mol
③4NO(g)+3O2(g)+2H2O(g)═4HNO3(aq)△H3kJ/mol
结合盖斯定律可知(①式×2+②式+③式)÷2即可得N2(g)+3H2(g)+4O2(g)═2HNO3(aq)+2H2O(l),故△H=(△H1+0.5△H2+0.5△H3)kJ/mol,
故答案为:(△H1+0.5△H2+0.5△H3).
点评 本题考查化学平衡的计算,为高频考点,把握平衡影响因素、盖斯定律应用、化学平衡三段法应用为解答的关键,侧重分析与计算能力的考查,综合性较强,题目难度不大.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.025 mol/L | B. | 0.30mol/L | C. | 0.36mol/L | D. | 0.45mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.20 | |
| 4 | 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向大气中排放过量的二氧化碳是造成全球气候变暖的重要因素,所以二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.
向大气中排放过量的二氧化碳是造成全球气候变暖的重要因素,所以二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向. ;将足量的C02通入下列溶液中,最终溶液变浑浊的是ce.
;将足量的C02通入下列溶液中,最终溶液变浑浊的是ce.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示①②③④分别是几种常见漏斗的上部,A、B、C、D是实际操作应用时,各漏斗的下部插入容器中的示意图.请指出A、B、C、D分别与①②③④相匹配的可能组合:A与③; B与②④(或①②④);C与①; D与④.
如图所示①②③④分别是几种常见漏斗的上部,A、B、C、D是实际操作应用时,各漏斗的下部插入容器中的示意图.请指出A、B、C、D分别与①②③④相匹配的可能组合:A与③; B与②④(或①②④);C与①; D与④.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
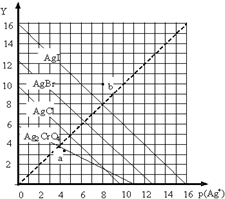 一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )
一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )| A. | a点表示c(Ag+)=c(CrO42-) | |
| B. | b点可表示AgI的饱和溶液 | |
| C. | 该温度下AgI的Ksp约为1×10-16 | |
| D. | 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锥形瓶可用作加热的反应器 | |
| B. | 室温下,不能将浓硫酸盛放在铁桶中 | |
| C. | 在50mL量筒中配置0.1000mol•L-1碳酸钠溶液 | |
| D. | 用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com