
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源:2016届广东省惠州市高三上学期第二次调研测试化学试卷(解析版) 题型:实验题
乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得。
I.制备碳酸亚铁:装置如图所示。
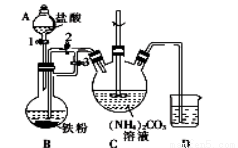
(1)装置B发生反应的离子方程式为_______________________;B中可观察到的现象是铁粉逐渐溶解,_________________________。
(2)将B中生成的FeCl2溶液压入装置C的操作是______________________。
Ⅱ.制备乳酸亚铁:
将制得的FeCO3加入乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后再加入适量乳酸。
(3)FeCO3与乳酸[CH3CH(OH)COOH]反应的离子方程式为_________________________。
(4)反应后加入适量乳酸的作用是________________。
(5)从所得溶液中获得乳酸亚铁晶体所需的实验操作是______ _、过滤、洗涤、干燥。
(6)设计实验证明乳酸亚铁中含Fe2+ ____________________ _________。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上学期第二次模拟化学试卷(解析版) 题型:选择题
依据下列实验现象,得出的结论正确的是
操作 | 实验现象 | 结论 | |
A | 向NaBr溶液中加入氯水,再加入淀粉KI溶液 | 溶液变蓝 | 氧化性:Cl2>Br2>I2 |
B | 将铝片放入盐酸中 | 产生气泡的速率开始时较慢,随后加快,后来又逐渐减慢 | H+的浓度是影响反应速率的唯一因素 |
C | 向蔗糖溶液中加入稀硫酸,水浴加热后,加入新制氢氧化铜,加热 | 得到蓝色溶液 | 蔗糖水解产物没有还原性 |
D | 向漂白粉中滴入稀硫酸,将生成的气体通入品红溶液 | 品红溶液褪色 | 气体中含有Cl2 |
查看答案和解析>>
科目:高中化学 来源:2016届江苏省南京市六校高三上学期12月联考化学试卷(解析版) 题型:填空题
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) + CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g)+CO(g) △H>0
CH3OH(g)+CO(g) △H>0
①第一步反应的机理可以用下图表示:
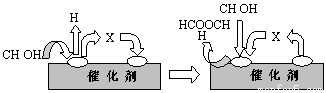
图中中间产物X的结构简式为 。
②在工业生产中,为提高CO的产率,可采取的合理措施有 。(写两条措施)
(3)第21届联合国气候变化大会(COP21)于2015年11月30日至12月11日在巴黎召开。会议旨在讨论控制温室气体CO2的排放,减缓全球变暖,力争将全球气温上升控制在2度内。
①Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。请写出700℃时反应的化学方程式为: 。
②利用太阳能和缺铁氧化物[如Fe0.9O]可将富集到的廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如下图所示,若用1mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成 molC(碳)。

③固体氧化物电解池(SOEC)用于高温电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如下图。
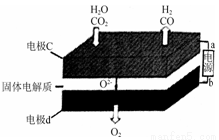
写出电极c上发生的电极反应式: , 。
(4)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见下图。

如何解释图中250-400℃时温度升高与乙酸的生成速率变化的关系? 。
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
某无色溶液中可能存在Al3+、H+、Na+、SO32—、CO32—、NO3—、AlO2—和S2—八种离子中的几种,进行如下实验:①向溶液中加入足量的稀盐酸,产生无色气体;②继续滴加BaCl2溶液,产生白色沉淀;③过滤后,向滤液中逐滴加入NaOH溶液,产生白色沉淀;继续滴加,白色沉淀消失。由此推断原溶液
A.一定存在的离子是Na+、SO32—、NO3—、AlO2—
B.一定存在的离子是Na+、SO32—、CO32—、AlO2—
C.可能存在的离子是Al3+、CO32—
D.可能存在的离子是CO32—、S2—
查看答案和解析>>
科目:高中化学 来源:2016届上海市十三校高三上学期第一次联考化学试卷(解析版) 题型:推断题
有机物M和乙炔可合成3-羟基丁酸,3-羟基丁酸可以生成一种生物降解塑料PHB和通过两步反应生成另一种高聚物C:
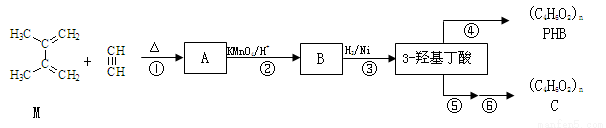
已知:i. 步骤②只有一种产物;C的结构中不含有甲基
ii. 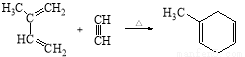
iii. 
41.M的系统命名为 。反应②反应类型 ,反应⑤的反应试剂及条件 。
42.写出B、C结构简式:B ,C 。
43.写出反应④化学方程式 ;
44.满足下列条件的B的同分异构体的结构简式为 。
a. 能发生银镜反应 b.分子中仅含2种化学环境不同的氢原子
45.理论上A也可以由1,3-丁二烯与烃F来合成,则F的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2016届上海市十三校高三上学期第一次联考化学试卷(解析版) 题型:选择题
化学与社会、生产、生活密切相关。下列说法正确的是
A.苯酚遇石蕊显红色 B.食用花生油能发生水解反应
C.包装用材料聚氯乙烯属于烃 D.PX项目中的对二甲苯属于饱和烃
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上学期第三次月考化学试卷(解析版) 题型:填空题
已知Cr(OH) 3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬。 具体流程如下:
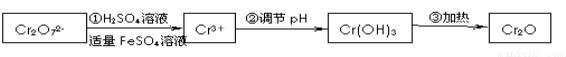
有关离子完全沉淀的pH如下表:
有关离子 | Fe2+ | Fe3+ | Cr3+ |
完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(1)写出Cr2O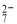 与FeSO4溶液在酸性条件下反应的离子方程式__________________。
与FeSO4溶液在酸性条件下反应的离子方程式__________________。
(2)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂最好为:_____________(填序号);
A.Na2O2 B.Ca(OH)2 C.Ba(OH)2 D.NaOH
此时调节溶液的pH范围在____________(填序号)最佳。
A.12~14 B.10~11 C.6~8 D.3~4
(3)将等体积的4.0×10-3mol·L-1的AgNO3和4.0×10-3mol·L-1的K2CrO4溶液混合能析出Ag2CrO4沉淀(Ksp(Ag2CrO4)=9.0×10-12),请写出表示Ag2CrO4溶解平衡的方程式,并简要写出能生成Ag2CrO4沉淀原因的计算过程。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省、修水一中高三上学期联考化学试卷(解析版) 题型:选择题
化学中常借助曲线图来表示某种变化过程,如有人分别画出了下列的四个曲线图:
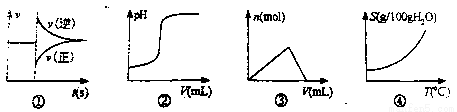
有关上述曲线图的说法正确的是( )
A.曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B.曲线图②可以表示向一定量的硫酸溶液中滴加一定浓度的氢氧化钠溶液时pH的变化
C.曲线图③可以表示向一定量的明矾溶液中滴加一定浓度的氢氧化钡溶液时产生沉淀的物质的量变化
D.曲线图④可以表示所有的固体物质溶解度随温度的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com