
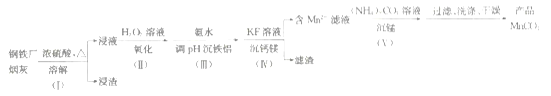
【题目】一种利用钢铁厂烟灰(含Fe、Mn、SiO2,少量的Al2O3、CaO及MgO)制备MnCO3的工艺流程如下:
已知25℃时,下列难溶物的溶度积常数:
难溶物 | CaF2 | MgF2 | MnCO3 | Mn(OH)2 |
Ksp | 4.0×10-11 | 6.4×10-9 | 2.2×10-11 | 1.9×10-13 |
回答下列问题:
(1)步骤(Ⅰ)浸渣的主要成分是______________(填化学式)。
(2)步骤(Ⅱ)加H2O2溶液时反应的离子方程式为________________;
加氨水调节pH沉铁铝时,步骤(Ⅲ)应调节的pH适宜范围为____________。(部分金属离子开始沉淀与沉淀完全的pH范围如下)
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Mg2+ |
沉淀pH范围 | 7.6~9.6 | 2.7~3.7 | 3.4~5.2 | 8.3~9.3 | 9.6~11.1 |
(3)步骤(Ⅳ)用KF溶液沉钙镁时,要使c(Ca2+)、c(Mg2+)均小于1×10-6mol·L-1,则应控制反应液中c(F-)>___________mol·L-1;反应MgF2(s)+Ca2+![]() CaF2(s)+Mg2+的平衡常数K=___________。
CaF2(s)+Mg2+的平衡常数K=___________。
(4)步骤Ⅴ沉锰时,在60℃按投料比n[(NH4)2CO3]/n(Mn2+)=2,溶液的pH对MnCO3产率的影响如图所示;pH=7,按投料比n[(NH4)2CO3]/n(Mn2+)=2,反应温度对MnCO3产率的影响如图所示。
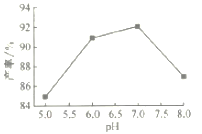
①上图中,在pH<7.0时,pH越小产率____________(填“越高”或“越低”;在pH>7.0时,pH越大产率越低且纯度也降低,其原因是___________________。
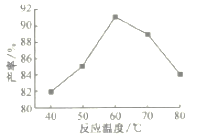
②上图中,温度高于60℃时,温度越高产率越低且纯度也越低,主要原因是______________。
【答案】SiO2 2Fe2++H2O2+2H+-2Fe3++2H2O 5.2~8.3 0.08 160 越低 部分MnCO3转化为溶解度更小的Mn(OH)2 温度越高MnCO3水解程度越大[或温度升高,(NH4)2CO3和MnCO3也会热分解]
【解析】
由流程图可知,向钢铁厂烟灰中加入浓硫酸并加热,烟灰中Fe、Mn、Al2O3、CaO及MgO溶解,酸性氧化物SiO2不溶解,过滤得到浸液和浸渣;向浸液中加入双氧水溶液,将亚铁离子氧化为铁离子,加入氨水调节溶液pH,铁离子和铝离子转化为氢氧化铁和氢氧化铝沉淀,加入氟化钾溶液,将钙离子和镁离子转化为氟化钙和氟化镁沉淀,过滤得到含锰离子的滤液和滤渣;向含锰离子的滤液中加入碳酸铵溶液,锰离子转化为碳酸锰沉淀,过滤、洗涤、干燥得到碳酸锰产品。
(1)步骤(Ⅰ)浸渣的主要成分是不与浓硫酸反应的酸性氧化物二氧化硅,故答案为:SiO2;
(2)步骤(Ⅱ)加H2O2溶液时,双氧水将溶液中的亚铁离子氧化为铁离子,反应的离子方程式为2Fe2++H2O2+2H+-2Fe3++2H2O;加入氨水的目的是调节溶液pH,使溶液中铁离子和铝离子转化为氢氧化铁和氢氧化铝沉淀而除去,而锰离子不能沉淀,由题给表格数据可知,应调节的pH适宜范围为5.2~8.3,故答案为:2Fe2++H2O2+2H+-2Fe3++2H2O;5.2~8.3;
(3)用KF溶液沉钙镁时,溶解度小的CaF2沉淀先生成,MgF2沉淀后生成,则c(Mg2+)小于1×10-6mol·L-1时,溶液中c(F-)>![]() mol/L;反应MgF2(s)+Ca2+
mol/L;反应MgF2(s)+Ca2+![]() CaF2(s)+Mg2+的平衡常数K=
CaF2(s)+Mg2+的平衡常数K=![]() =160,故答案为:0.08;160;
=160,故答案为:0.08;160;
(4) ①由图可知,在60℃按投料比n[(NH4)2CO3]/n(Mn2+)=2时,在pH<7.0时,pH越小MnCO3产率越小;由表格所给溶度积可知,pH>7.0时,溶液碱性增强, MnCO3部分会转化为溶解度更小的Mn(OH)2,导致产率和纯度降低,故答案为:越低;部分MnCO3转化为溶解度更小的Mn(OH)2;
②由图可知,60℃时,MnCO3产率最大,温度高于60℃时,温度升高MnCO3水解程度越大,(NH4)2CO3和MnCO3也会热分解,导致产率和纯度降低,故答案为:温度越高MnCO3水解程度越大[或温度升高,(NH4)2CO3和MnCO3也会热分解]。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)按照系统命名法写出下列烷烃的名称:
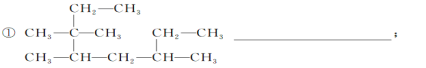 _____
_____
 ___
___
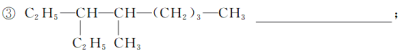 ___
___
 _____
_____
(2)根据下列有机物的名称,写出相应的结构简式:
①2,4二甲基戊烷_________________________
②2,2,5三甲基3乙基己烷__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取纯硅的主要反应:SiCl4 + 2H2 ![]() Si + 4HCl。该反应中,被还原的物质是______(填化学式),作为还原剂的物质是______(填化学式);若反应中生成了1 mol Si,则消耗H2 ______mol。
Si + 4HCl。该反应中,被还原的物质是______(填化学式),作为还原剂的物质是______(填化学式);若反应中生成了1 mol Si,则消耗H2 ______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校科学兴趣小组探究二氧化碳与过氧化钠反应是否有氧气生成,设计了如图的实验装置.B中盛有饱和碳酸氢钠溶液,目的是除去二氧化碳中混有的氯化氢气体,E为收集氧气装置.
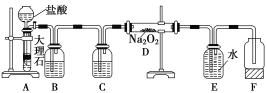
(1)写出装置A中发生反应的化学方程式____________。
(2)C中盛有____________,目的是_____________。
(3)写出装置D中发生反应的化学方程式__________。
(4)指出装置E的错误_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。
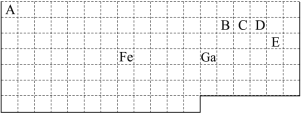
根据信息回答下列问题。
(1)周期表中基态Ga原子的最外层电子排布式为 。
(2)Fe元素位于周期表的 区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为 ;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 和 (填化学式)。
(3)在CH4、CO2、CH3OH中,碳原子采取sp3杂化的分子有 。
(4)根据VSEPR理论预测ED4-离子的空间构型为 。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为 (写2种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应2X(g)+Y2(g)![]() 2XY(g);△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,下列分析正确的是
2XY(g);△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,下列分析正确的是
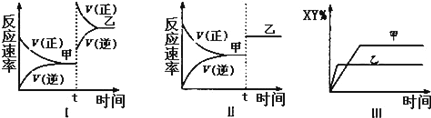
A. 图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2
B. 图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低
C. 图Ⅱ中,t时间是增大了压强
D. 图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫一空气质子交换膜燃料电池将化学能转变成电能的同时,实现了制硫酸、发电、环保三位一体的结合,其原理如图所示。下列说法错误的是
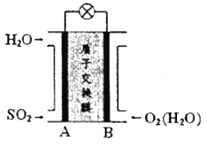
A. 负极的电极反应式为SO2+2H2O-2e-=SO42-+4H+
B. 反应总式为2SO2+O2+2H2O=2H2SO4
C. 质子的移动方向为从电极B到电极A
D. SO2气流速度的大小可能影响电池的电动势
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。

根据信息回答下列问题。
(1)周期表中基态Ga原子的最外层电子排布式为 。
(2)Fe元素位于周期表的 区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为 ;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 和 (填化学式)。
(3)在CH4、CO2、CH3OH中,碳原子采取sp3杂化的分子有 。
(4)根据VSEPR理论预测ED4-离子的空间构型为 。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为 (写2种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com