
����Ŀ���������ƣ�NaNO2����һ�ֳ�����ʳƷ���Ӽ���ʹ��ʱ�����ϸ������������ij��ȤС���������ʵ��̽������������֪����
��2NO+Na2O2=2NaNO2
��2NO2+Na2O2=2NaNO3
������KMnO4��Һ�ɽ�NO2������ΪNO3����MnO4������ԭ��Mn2+��
��Ʒ�Ʊ�����飺��ͼ20װ���Ʊ�NaNO2
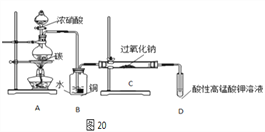
��1��д��װ��A��ƿ�з�����Ӧ�Ļ�ѧ����ʽ________________��
��2��Bװ�õ�������___________��ʢŨ�������������Ϊ__________��
��3����ͬѧ��Ϊװ��C�в��ﲻ�����������ƣ�����̼���ƺ��������ƣ�Ϊ�Ʊ�������NaNO2��Ӧ��B��Cװ�ü�����һ������ܡ��ڸ������ʢ�ŵ��Լ�����Ϊ____________��
��4�������ʵ�飬����װ��C��NaNO2�Ĵ��ڣ�д������������ͽ��ۣ�_________��
�����IJⶨ
��ȡװ��C�з�Ӧ��Ĺ���4.00g����ˮ���250mL��Һ��ȡ25.00mL��Һ����ƿ�У���0.1000mol/L����KMnO4��Һ���еζ���ʵ�������������±���ʾ��
����� | 1 | 2 | 3 | 4 |
KMnO4��Һ���/mL | 20.60 | 20.02 | 20.00 | 19.98 |
��5����һ��ʵ�����ݳ����쳣����������쳣��ԭ�������_________��
A����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
B����ƿϴ����δ����
C���ζ����������Ӷ���
D���ζ��������Ӷ���
��6�����ݱ������ݣ��������ù������������Ƶ���������_______��
���𰸡� C+4HNO4(Ũ)![]() CO2��+4NO2��+2H2O ��NO2ת��ΪNO��ͬʱCu��ϡ���ᷴӦ����NO������ȡNO�� ��Һ©�� ��ʯ�ң���2�֣� ȡ����װ��C�в��������Թ��У�������������ˮ�ܽ⣬�μ���������KMnO4��Һ������Һ��ɫ��ȥ��˵��C�в��ﺬ��NaNO2 A��C 86.25%��0.8625
CO2��+4NO2��+2H2O ��NO2ת��ΪNO��ͬʱCu��ϡ���ᷴӦ����NO������ȡNO�� ��Һ©�� ��ʯ�ң���2�֣� ȡ����װ��C�в��������Թ��У�������������ˮ�ܽ⣬�μ���������KMnO4��Һ������Һ��ɫ��ȥ��˵��C�в��ﺬ��NaNO2 A��C 86.25%��0.8625
��������������1��װ��A��C��Ũ���ᷴӦ�Ļ�ѧ����ʽ�ķ���ʽΪ��C+4HNO3��Ũ��CO2��![]() +4NO2��+2H2O��
+4NO2��+2H2O��
��2������ʵ��װ�ÿ�֪��װ��C�з�����Ӧ��2NO+Na2O2=2NaNO2����װ��B�������ǽ�NO2ת��ΪNO��ͬʱCu��ϡ���ᷴӦ����NO������ȡNO������������ṹ��֪��ʢŨ�������������Ϊ��Һ©����
��3��Ϊ�Ʊ�����NaNO2����Ҫ������װ��C�������еĶ�����̼��ˮ��ȥ����ʯ���ܹ����ն�����̼��ˮ���ʿ���ѡ�ü�ʯ�ң�
��4������������Ϣ��֪������KMnO4��Һ�ɽ�NO2-����ΪNO3-��MnO4-��ԭ��Mn2+���ݴ˿���Ƴ������������Ƶķ���Ϊ��ȡ����װ��C�в��������Թ��У�������������ˮ�ܽ⣬������ϡ�����ữ���μ���1-2�Σ�����������KMnO4��Һ������Һ��ɫ��ȥ��˵��C�в��ﺬ��NaNO2��
������һ��ʵ���������ĵ����Ը��������Һ���ƫ�ᵼ�²������ƫ�ߣ�A����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ�����±�Һ��ϡ�ͣ��ζ����������ĵı�Һ�����ƫ��A��ȷ��B����ƿ����Ҫ���������ƿϴ����δ�����Ӱ��ⶨ�������B����C���ζ��������Ӷ��������¶���ƫ������ı�Һ���ƫ��C��ȷ��D���ζ����˸��Ӷ������ζ��ܶ���ƫС��������ı�Һ���ƫС����D���ʴ�ΪAC��
��6�����ڵ�һ������ƫ�ߣ�Ӧ�������������������ı�Һƽ�����Ϊ�� ![]() mL=20.00mL��25mL��Ʒ���ĸ�����ص����ʵ���Ϊ��0.1000mol/L��0.02L=0.002mol����250mL��Ʒ��Һ�����ĸ�����ص����ʵ���Ϊ��0.002mol��
mL=20.00mL��25mL��Ʒ���ĸ�����ص����ʵ���Ϊ��0.1000mol/L��0.02L=0.002mol����250mL��Ʒ��Һ�����ĸ�����ص����ʵ���Ϊ��0.002mol��![]() =0.02mol�����ݻ��ϼ۱仯�ɵ÷�Ӧ��ϵʽ��2MnO4-��5NO2-����4.000g��Ʒ�к����������Ƶ����ʵ���Ϊ��0.02mol��
=0.02mol�����ݻ��ϼ۱仯�ɵ÷�Ӧ��ϵʽ��2MnO4-��5NO2-����4.000g��Ʒ�к����������Ƶ����ʵ���Ϊ��0.02mol��![]() =0.05mol������Ϊ69g/mol��0.05mol=3.45g�����Է�Ӧ��Ĺ������������Ƶ���������Ϊ��
=0.05mol������Ϊ69g/mol��0.05mol=3.45g�����Է�Ӧ��Ĺ������������Ƶ���������Ϊ�� ![]() ��100%=86.25%��
��100%=86.25%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ���ʱ����С�Ľ�����ʳ�λ�ϣ��������߷��뿪����õķ����ǣ� ��
A. �ܽ⡢����B. �ܽ⡢���ˡ�����
C. �ܽ⡢����������Һ������D. ����ʹ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���3.0molM��2.5mol N�����2.0L���ܱ������У�������Ӧ�Ļ�ѧ����ʽΪ��3M(g)+N(g) ![]() XP(g)+2Q(g) ��5min��Ӧ�ﵽƽ�⣬�����ڵ�ѹǿ��С����֪Q��ƽ����Ӧ����Ϊ0.01mol��L-1��min-1������˵��������ǣ� ��
XP(g)+2Q(g) ��5min��Ӧ�ﵽƽ�⣬�����ڵ�ѹǿ��С����֪Q��ƽ����Ӧ����Ϊ0.01mol��L-1��min-1������˵��������ǣ� ��
A. X��ֵΪ1 B. M��ƽ����Ӧ����Ϊ0.15 molL-1��min-1
C. M��ת����Ϊ60% D. ƽ��ʱP��Ũ��Ϊ0.25 molL-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ���Ũ��Ϊ0��1molL��1��Na2CO3��Һ100 mLʱ�����в�����ȷ����
A. ��������ƽ��ȡ1��06 g ��ˮ̼���ƣ����ձ��м�����ˮ�ܽ⣬����ȴ�����º���Һת�Ƶ�����ƿ��
B. ��ʹ������ƿǰ����������ƿ�Ƿ�����Լ�ƿ�����Ƿ�©ˮ
C. ����ʱ������ˮ�����̶��ߣ����ý�ͷ�ι�С���������ಿ��
D. ����ʱ�������ӣ���������Һ��Ũ�Ƚ�ƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µĺ���������.���������������ٷ����仯ʱ�����ܱ�����Ӧ��A(s)+3B(g)![]() 2C(g)+D(g)����ƽ��״̬���ǣ� ��
2C(g)+D(g)����ƽ��״̬���ǣ� ��
A. ��������ѹǿ B. ���������ܶ�
C. 3v��(C)=2v��(B) D. �����ƽ����Է�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ֹ⻯ѧ��صĽṹ����ͼ���������ڱ���Ϳ���Ȼ�������Ƭ��ʱ��������Ӧ��AgCl(s) ![]() Ag(s)+Cl(AgCl)�� [Cl(AgCl)��ʾ���ɵ���ԭ���������Ȼ�������]������Cl(AgCl)+e����Cl��(aq)��������Դ�Ƴ�����ػ������ظ�����ʼ״̬������˵����ȷ����
Ag(s)+Cl(AgCl)�� [Cl(AgCl)��ʾ���ɵ���ԭ���������Ȼ�������]������Cl(AgCl)+e����Cl��(aq)��������Դ�Ƴ�����ػ������ظ�����ʼ״̬������˵����ȷ����

A. ����ʱ��������Y����X
B. ����ʱ����ת��0.1mole-ʱ��Pt�缫����0.05molCl2����
C. ����ʱ��Cl����Ag�缫�ƶ�
D. ����ʱ������ܷ�ӦΪ��AgCl(s) +Cu+(aq) ![]() Ag(s)+Cu2+(aq)+Cl��
Ag(s)+Cu2+(aq)+Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɳ����������Է���ʹ�ö����ܹ��������ϲ����������ݶԿɳ���ص����⣬ѡ�������й�˵����ȷ���ǣ� ��
A. �ŵ�ʱ��������ת��Ϊ����
B. �ŵ�ʱ����������������Ӧ
C. ���ʱ����صĸ���������ԭ��Ӧ
D. ���ʱ���ѻ�ѧ��ת��Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��ݾ����ܱ������У�����2NO2![]() N2O4 (����ӦΪ���ȷ�Ӧ)������˵������֤���÷�Ӧ�ﵽƽ��״̬����
N2O4 (����ӦΪ���ȷ�Ӧ)������˵������֤���÷�Ӧ�ﵽƽ��״̬����
A. ��ϵ�¶Ȳ��ٸı��״̬ B. ��ϵ�ܶȲ��ٸı��״̬
C. ��ϵ�������ƽ��Ħ���������ٸı��״̬ D. ��ϵѹǿ���ٸı��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Sb)���仯�����ڹ�ҵ����������;���Ի������Ҫ�ɷ�ΪSb2S3��������PbS��As2S3��CuO��SiO2�ȣ�Ϊԭ���Ʊ�������Ĺ���������ͼ��ʾ��

��֪���� ����Һ�г������������SbCl5֮�⣬������SbCl3��PbCl2��AsCl3��CuCl2�ȣ�
�ڳ����£�Ksp(CuS)=1.27��10-36��Ksp(PbS)=9.04��10-29��
����Һ������Ũ��С�ڵ���1.0��10-5mol��L-1ʱ����Ϊ�����ӳ�����ȫ��
��1������1�г���S֮�⣬����___________���ѧʽ����
��2����������ʱ��Sb2S3������Ӧ�Ļ�ѧ����ʽΪ_________________��
��3������ԭ��ʱ����Sb��ԭ������Ϊ_____________���ѧʽ����
��4�������£�����ͭ��Ǧ��ʱ��Cu2+��Pb2+��������ȫ����ʱ��Һ�е�c(S2-)������______������Na2SҲ���˹��࣬��ԭ��Ϊ_____________��
��5�������顱ʱ��H3PO3���ɣ��÷�Ӧ�Ļ�ѧ����ʽΪ________________��
��6������⡱ʱ����������SbԪ���뱻��ԭ��SbԪ�ص�����֮��Ϊ_______��
��7��һ��ͻ�ƴ�ͳ�����������þ-��Һ̬�������ܵ�ع���ԭ����ͼ��ʾ��

�õ�������ܶȵIJ�ͬ�������������·�Ϊ���㣬����ʱ�м�������ε���ɲ��䡣���ʱ��C1-��_____����ϡ����¡����ƶ����ŵ�ʱ�������ĵ缫��ӦʽΪ________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com