
【题目】从海水提取镁和溴的流程如图,请回答相关问题。
(1)从海水中提取镁的流程如图所示(框图中是主要产物):
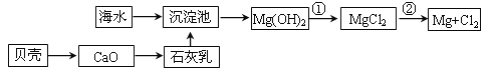
i.反应①的离子方程是_____;
ii.反应②的化学方程式是_____。
(2)从海水中提取溴的流程如图所示(框图中是主要产物):
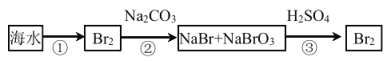
i.过程②中,向混合液中吹入热空气,将溴吹出,用纯碱吸收,吹入热空气的目的是______。
ii.过程③中反应的化学方程式是______。
iii.若最终得到的溴单质中仍然混有少量的Cl2,则除去该杂质的方法是______。(结合离子方程式回答)。
【答案】Mg(OH)2+2H+=Mg2++2H2O MgCl2(熔融) ![]() Mg+Cl2↑ 温度升高,气体的溶解度减小,另外空气不与溴发生反应,可以搅动液体,有利于溴蒸气的逸出 5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O 加入适量溴化钠,利用有机溶剂将溴分离提纯,Cl2+2Br-═Br2+2Cl-
Mg+Cl2↑ 温度升高,气体的溶解度减小,另外空气不与溴发生反应,可以搅动液体,有利于溴蒸气的逸出 5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O 加入适量溴化钠,利用有机溶剂将溴分离提纯,Cl2+2Br-═Br2+2Cl-
【解析】
(1)根据流程图中物质间的转化关系书写方程式;
(2) i.根据气体在水中的溶解度的影响因素结合溴易挥发分析热空气吹入法的原理和目的;ii.根据流程图中物质间的转化关系书写方程式;iii.根据氯气能将溴离子氧化为溴单质,结合除杂原则分析解答。
(1)i.反应①是Mg(OH)2与盐酸反应转化为MgCl2,反应的化学方程式为:2HCl+Mg(OH)2═MgCl2+2H2O,离子方程式为:Mg(OH)2+2H+=Mg2++2H2O,故答案为:Mg(OH)2+2H+=Mg2++2H2O;
ii.反应②为电解熔融的氯化镁生成镁和氯气,反应的化学方程式为MgCl2(熔融) ![]() Mg+Cl2↑,故答案为:MgCl2(熔融)
Mg+Cl2↑,故答案为:MgCl2(熔融) ![]() Mg+Cl2↑;
Mg+Cl2↑;
(2)i.溴是易挥发的液体单质,向混合液中吹入热空气,温度升高,气体的溶解度减小,另外空气不与溴发生反应,可以搅动液体,有利于溴蒸气的逸出,故答案为:温度升高,气体的溶解度减小,另外空气不与溴发生反应,可以搅动液体,有利于溴蒸气的逸出;
ii.过程③中酸性条件下NaBr、NaBrO3发生氧化还原反应生成溴单质,反应的化学方程式为3H2SO4+5NaBr+NaBrO3=3Na2SO4+3Br2+3H2O,故答案为:5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O;
iii.氯气具有氧化性,溴离子具有还原性,若最终得到的溴单质中仍然混有少量的Cl2,可以加入适量溴化钠,再利用有机溶剂将溴分离提纯,Cl2+2Br-═Br2+2Cl-,则可除去杂质氯气,故答案为:加入适量溴化钠,利用有机溶剂将溴分离提纯,Cl2+2Br-═Br2+2Cl-。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D四种可溶性盐,阳离子分别可能是Ba2+、Na+、Ag+、Cu2+中的某一种,阴离子分别可能是![]() 中的某一种。
中的某一种。
(1) C的溶液呈蓝色,向这四种盐溶液中分别加盐酸,B盐有沉淀产生,D盐有无色无味气体逸出。则它们的化学式应为:
A_______,B_______,C_______,D_______。
(2)写出下列反应的离子方程式:
①A+C__________________________。
②D+盐酸________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是功能性高分子材料的单体,化合物Y是一种抗菌药物,它们的结构简式如下图所示:
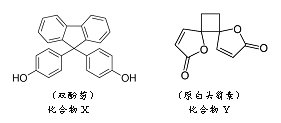
下列说法错误的是
A. X、Y均能与浓Br2水发生反应
B. X分子中四个苯环处于同一平面
C. X、Y分子中手性碳原子数依次为1个、2个
D. 1molX、1molY分别与NaOH反应时,最多消耗NaOH的物质的量均为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的化合物用途非常广泛。已知下列反应:[Cu(NH3)2]++NH3+CO![]() [Cu(NH3)3CO]+,2CH3COOH+2CH2=CH2+O2
[Cu(NH3)3CO]+,2CH3COOH+2CH2=CH2+O2![]() 2CH3COOCH=CH2+2H2O。
2CH3COOCH=CH2+2H2O。
(1)Cu2+基态核外电子排布式为____。
(2)NH3分子空间构型为____。
(3)CH3COOCH=CH2分子中碳原子轨道的杂化类型是_____,1molCH3COOCH=CH2中含![]() 键数目为____。
键数目为____。
(4)CH3COOH可与H2O混溶,除因为它们都是极性分子外,还因为_______。
(5)配离子[Cu(NH3)3CO]+中NH3及CO中的C与Cu(Ⅰ)形成配位键。不考虑空间构型,[Cu(NH3)3CO]+的结构可用示意图表示为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H[3-亚甲基异苯并呋喃-1(3H)-酮]的一种合成路线如下:
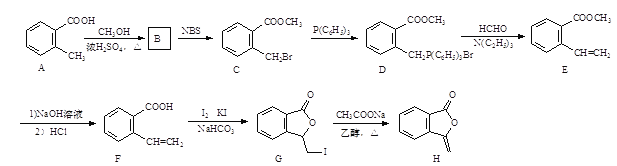
(1)C中所含官能团名称为_________和_________。
(2)G生成H的反应类型是________。
(3)B的分子式为C9H10O2,写出B的结构简式:________。
(4)E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_________。①分子中含有苯环,能使Br2的CCl4溶液褪色;
②碱性条件水解生成两种产物,酸化后分子中均只有4种不同化学环境的氢,其中之一能与FeCl3溶液发生显色反应。
(5)写出以![]() 、P(C6H5)3及N(C2H5)3为原料制备
、P(C6H5)3及N(C2H5)3为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)____。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。下列说法正确的是( )
X | Y | |
Z | W |
A.原子半径:X>Y>Z>W
B.若它们都能形成气态氢化物,则Z的氢化物稳定性最强
C.若常温下它们的单质中只有Z为固态,则W单质的水溶液具有漂白性
D.若X与W形成的化合物的电子式是![]() ,则Y属于第ⅣA族
,则Y属于第ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一,丙的浓溶液是具有强氧化性的酸溶液,上述物质的转化关系如图所示。下列说法正确的是( )
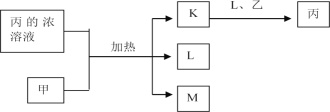
A. 电负性:W>X>YB. 原子的第一电离能:Z>Y>X
C. 由W、X、Y、Z构成化合物中只含共价键D. K、L、M中沸点最高的是M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A. 1 L 1 mol/L的Na2CO3溶液中含有的CO32-数目为![]()
B. 常温常压下,8 g O2含有的电子数是4NA
C. 标准状况下,2.24 L CCl4中含有的分子数为0.1NA
D. 25℃时,1 L pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过量的碳排放会引起严重的温室效应,导致海洋升温、海水酸化,全球出现大规模珊瑚礁破坏,保护珊瑚礁刻不容缓。
(1)海水中含有的离子主要有Na+、Mg2+、Ca2+、K+、Cl–、CO32–和HCO3–。其中,导致海水呈弱碱性的微粒有______。
(2)珊瑚礁是珊瑚虫在生长过程中吸收海水中物质而逐渐形成的石灰石外壳。形成珊瑚礁的主要反应为Ca2+ + 2HCO3- ![]() CaCO3↓+ CO2↑+ H2O。
CaCO3↓+ CO2↑+ H2O。
① 请结合化学用语分析该反应能够发生的原因:______。
② 与珊瑚虫共生的藻类通过光合作用促进了珊瑚礁的形成;而海洋温度升高会使共生藻类离开珊瑚礁,导致珊瑚礁被破坏。请分析珊瑚礁的形成和破坏会受到共生藻类影响的原因:______。
(3)研究人员提出了一种封存大气中二氧化碳的思路:将二氧化碳和大量的水注入地下深层的玄武岩(主要成分为CaSiO3)中,使其转化为碳酸盐晶体。玄武岩转化为碳酸盐的化学方程式为______。
(4)“尾气CO2直接矿化磷石膏联产工艺”涉及低浓度CO2减排和工业固废磷石膏处理两大工业环保技术领域,其部分工艺流程如下图所示。
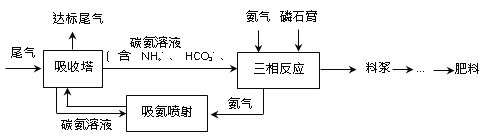
已知:磷石膏是在磷酸生产中用硫酸处理磷矿时产生的固体废渣,其主要成分为CaSO4·2H2O。
①吸收塔中发生的反应可能有______(写出任意2个反应的离子方程式)。
②料浆的主要成分是______(写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com