
分析 (1)由题意可知,PbO2与浓盐酸反应生成PbCl2、Cl2与H2O,发生还原反应的HCl生成氯气,表现酸性的HCl生成PbCl2;
(2)已知硫酸铅不溶于水,用化学式,铅蓄电池的工作原理为Pb+PbO2+2H2SO4═2PbSO4+2H20,写出该反应的离子方程式为:Pb+PbO2+4H++2SO42-=2PbSO4+2H2O;硫酸根离子检验的方法为取少量于试管中,向其中加足量稀盐酸,无明显现象,再加氯化钡溶液,得到白色沉淀,则说明溶液中存在硫酸根离子;
(3)①硫酸铅在水溶液里存在溶解平衡,加入醋酸铵时,醋酸根离子和铅离子生成难电离物质或弱电解质醋酸铅,促进硫酸铅溶解,醋酸铅能和硫化钠发生复分解反应生成黑色的硫化铅沉淀;
②+2价Sn的化合物具有强还原性,而+4价的Pb具有氧化性,等物质的量的PbO2和SnO的混合物溶于过量的稀硫酸中则发生氧化还原反应,而还原得到Pb2+与硫酸根离子结合为不溶于水的PbSO4.
解答 解:(1)由题意可知,PbO2与浓盐酸反应生成PbCl2、Cl2与H2O,反应方程式为:PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O,发生还原反应的HCl生成氯气,表现酸性的HCl生成PbCl2,反应中表现还原性的HCl与表现酸性的HCl的物质的量之比为1:1,
故答案为:PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;1:1;
(2)已知硫酸铅不溶于水,用化学式,铅蓄电池的工作原理为Pb+PbO2+2H2SO4═2PbSO4+2H20,写出该反应的离子方程式为:Pb+PbO2+4H++2SO42-=2PbSO4+2H2O;硫酸根离子检验的方法为取少量于试管中,向其中加足量稀盐酸,无明显现象,再加氯化钡溶液,得到白色沉淀,则说明溶液中存在硫酸根离子,故答案为:Pb+PbO2+4H++2SO42-=2PbSO4+2H2O;取少量于试管中,向其中加足量稀盐酸,无明显现象,再加氯化钡溶液,得到白色沉淀,则说明溶液中存在硫酸根离子;
(3)①硫酸铅在水溶液里存在溶解平衡,加入醋酸铵时,醋酸根离子和铅离子生成的醋酸铅,属于难电离物质或弱电解质,促进硫酸铅溶解,所以硫酸铅能溶于醋酸铵溶液中;醋酸铅能和硫化钠发生复分解反应生成黑色的硫化铅沉淀,符合复分解反应的条件,离子反应方程式为:(CH3COO)2 Pb+S2-=PbS↓+2CH3COO-,
故答案为:难电离物质或弱电解质;(CH3COO)2 Pb+S2-=PbS↓+2CH3COO-;
②因为+2价Sn的化合物具有强还原性,而+4价的Pb具有氧化性,所以等物质的量的PbO2和SnO的混合物溶于过量的稀硫酸中则发生氧化还原反应生成Pb2+和Sn4+,Pb2+与硫酸根离子结合为不溶于水的PbSO4,则溶液中存在的主要金属阳离子是Sn4+,故选:D.
点评 本题考查氧化还原反应有关计算、沉淀溶解平衡与转化等,侧重考查学生分析计算能力,难度中等.


科目:高中化学 来源: 题型:选择题
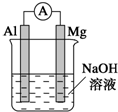 将镁条、铝条平行插入一定浓度的NaOH溶液中,用导线和电流表连接成原电池.装置如图所示,此电池工作时,下列叙述中正确的是( )
将镁条、铝条平行插入一定浓度的NaOH溶液中,用导线和电流表连接成原电池.装置如图所示,此电池工作时,下列叙述中正确的是( )| A. | Mg比Al活泼,Mg失去电子被氧化成Mg2+ | |
| B. | 铝条表面虽有氧化膜,但可不必处理 | |
| C. | 正极反应式为2H++2e-═H2↑ | |
| D. | Al是电池负极,开始工作时溶液中会立即有白色沉淀析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
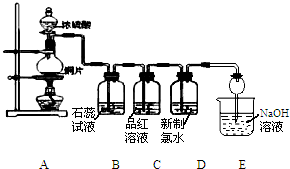 某化学兴趣小组为探究SO2的化学性质,设计了如图所示的装置进行实验.回答下列问题:
某化学兴趣小组为探究SO2的化学性质,设计了如图所示的装置进行实验.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液 | B. | 胶体 | C. | 悬浊液 | D. | 乳浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子质量 | B. | 质量 | C. | 密度 | D. | 原子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 5mL,反应温度 10℃ | |
| B. | 0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 10mL,反应温度 10℃ | |
| C. | 0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 5mL,反应温度 30℃ | |
| D. | 0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 10mL,反应温度 30℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
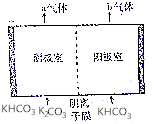 为实现CO2减排,目前较成熟的方法是用碳酸钾溶液为吸收剂捕集工业烟气中的CO2.利用电解法可实现吸收后的溶液(称为富液)的再生.将富液通人阴极室,将KHCO3溶液加入阳极室进行电解,其原理如图所示.下列有关描述不正确的是( )
为实现CO2减排,目前较成熟的方法是用碳酸钾溶液为吸收剂捕集工业烟气中的CO2.利用电解法可实现吸收后的溶液(称为富液)的再生.将富液通人阴极室,将KHCO3溶液加入阳极室进行电解,其原理如图所示.下列有关描述不正确的是( )| A. | 阴极室产生的a气体是H2 | B. | 阳极室产生的b气体是CO2 | ||
| C. | 阴离子从阴极室向阳极室迁移 | D. | 再生液(K2CO3)在阴极室产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com