
【题目】下列图示与对应的叙述相符的是
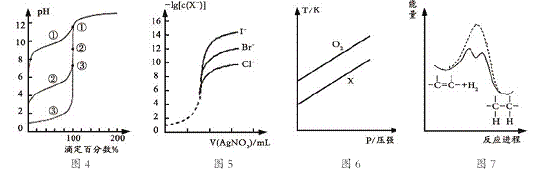
A.用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由图4曲线确定①的酸性最强
B.用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/L Cl-、Br-及I-的混合溶液,由图5曲线,可确定首先沉淀的是Cl-
C.在体积相同的两个密闭容器中,分别充入相同质量O2和X气体,由图6可确定X可能是CH4气体
D.由图7可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行
 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如图所示(部分产物已略去):
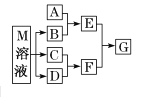
(1)写出B的电子式________。
(2)写出由M溶液制B、C、D的化学方程式___________________________________。
(3)若A是一种常见的酸性氧化物,且可用于制造玻璃,写出A和B水溶液反应的离子方程式___________________________________。
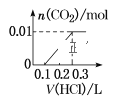
(4)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,生成的CO2物质的量与所用盐酸体积如图所示,则A与B溶液反应后溶液中溶质的化学式为_______。
(5)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_________________________________。
(6)若A是一种氮肥, A和B反应可生成气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式为________________。
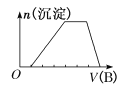
(7)若A是一种溶液,可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32- 、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子的物质的量浓度之比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国是一个严重缺水的国家,污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法不正确的是
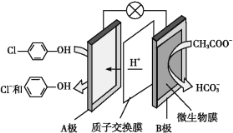
A. 电流方向从A极沿导线经小灯泡流向B极
B. B极为电池的阳极,电极反应式为CH3COO—— 8e + 4H2O ═ 2HCO3—+9H+
C. 当外电路中有0.2 mol e转移时,通过质子交换膜的H+的个数为0.2NA
D. A极的电极反应式为![]() + H++2e ═ Cl+
+ H++2e ═ Cl+ ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)CH3OH(g) ΔH1= -90 kJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g) ΔH2= -41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:_______________________。
(2)在容积为VL的容器中充入amol CO与2amol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示。

①p1 ________ p2(填“大于”、“小于”或“等于”);
②在温度、体积不变的情况下,再增加amol CO与2amol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”),平衡常数_____(填“增大”、“减小”或“不变”)。
(3)已知在T℃时,CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,此时刻υ正 ______υ逆 (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。反应①常被应用于野外焊接钢轨,②是工业上重要的反应之一。
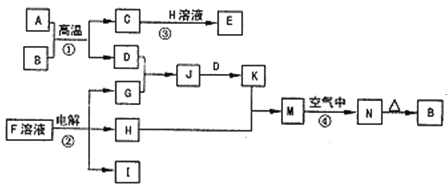
请回答下列问题:
(1)H的电子式是___,其中含有的化学键类型是___。
(2)写出反应④的现象:___,有关反应的化学方程式为___。
(3)已知I的燃烧热是-285.8kJmol-1,则1m3(标准状况)I完全燃烧,恢复至室温时放出的热量是__(计算结果保留3位有效数字)。
(4)25℃时,以Pt为电极电解含有少量酚酞的F的饱和溶液,则在___(填“阴”或“阳”)极附近溶液由无色变为红色,若在此极收集到0.2g气体,则此时溶液的pH是__(假设溶液的体积为2L且不考虑电解后溶液体积的变化)。
(5)在K溶液中加入与K等物质的量的Na2O2,恰好使K转化为N。写出该反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽.接通电路后发现B上的c点显红色.为实现铁上镀铜,接通K后,使c、d两点短路.下列叙述正确的是( )
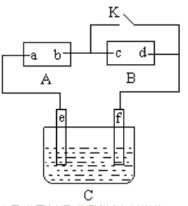
A.a为直流电源的负极
B.c极发生的反应为2Cl--2e-=Cl2↑
C.f电极为铜板
D.e极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是地壳中含量非常丰富的元素,金属铁是在高炉中冶炼的,在冶金工业中,常用焦炭来冶炼铁。
(1)写出焦炭在高炉中所参加的两个反应的化学方程式: ________________。
(2)写出赤铁矿被![]() 还原成铁的化学方程式:__________________________。
还原成铁的化学方程式:__________________________。
(3)实验室中可用![]() 还原
还原![]() ,在加热
,在加热![]() 前应先_________,否则可能发生________现象;未反应完的
前应先_________,否则可能发生________现象;未反应完的![]() ___________(填“能”或“不能”)排放到大气中,应做________处理。
___________(填“能”或“不能”)排放到大气中,应做________处理。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物广泛应用于高新材料领域,请回答下列有关问题:
(1)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图)。
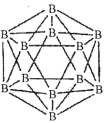
①在基态11B原子中,核外存在______对自旋相反的电子。
②若每个单元中有两个原子为l0B,其余为11B,则该单元结构的类型有______种。
(2)NaBH4是一种重要的储氢载体,其中涉及元素的电负性由小到大的顺序为________,BH4-离子的空间构型是_____________,与BH4-互为等电子体的的分子有___________。
(3)硼酸(H3BO3)为白色片状晶体,有与石墨相似的层状结构,则硼酸晶体中存在的作用力有共价键、_____、_______。与H3BO3酸性最接近的是__________(填字母)。
A.H4SiO4 B.H3PO4 C.HNO2
(4)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。如图是磷化硼晶体的晶胞,B原子的杂化方式是___________。立方相氮化硼晶体的熔点要比磷化硼体高,其原因是_____________。
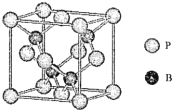
(5)己知磷化硼的晶胞参数a=478 pm,请列式计算该晶体的密度p=_____g.cm-3(用含NA的代数式表示即可,不需要计算出结果)。晶胞中硼原子和磷原子最近的核间距为_________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用标准浓度氢氧化钠的溶液来滴定未知浓度的盐酸,下列操作中会使盐酸测定的浓度偏大的是( )
①碱式滴定管用蒸馏水洗净后未用标准溶液润洗
②锥形瓶中盛有少量蒸馏水,再加待测液
③酸式滴定用蒸馏水洗净后,未用盐酸润洗
④滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
⑤滴定后观察碱式滴定管读数时,俯视刻度线
A.①④B.①③C.②③D.④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com