
分析 (1)锰原子序数为25,根据能量最低原则、泡利不相容原理和洪特规则书写;
(2)反应中涉及的属于同主族元素为O、S,同主族自上而下元素第一电离能减小;
(3)①根据价层电子对=σ 键电子对+中心原子上的孤电子对,结合S2O8 2-结构判断杂化类型;
②氧化还原反应中,元素的化合价降低,被还原;
③反应中S2O8 2-中过氧键发生断裂生成SO42-;
(4)①每个水分子为3个五边形共用,该结构中水分子数目为$\frac{12×5}{3}$=20,而每个水分子形成3个氢键,每个氢键为1个水分子提供$\frac{1}{2}$;
②冰中氢键的作用能为18.8kJ•mol-1,而冰熔化热为5.0kJ•mol-1,说明冰熔化为液态水时只是破坏了一部分氢键,并且液态水中仍在氢键;
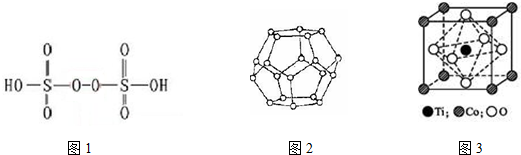
(5)利用均摊法计算晶胞中Ti、Co、O原子数目,进而确定化学式;
(6)铑的某配合物的化学式为CsRh(SO4)2•4H2O,该物质易溶于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成,说明硫酸根处于内界,
解答 解:(1)锰原子序数为25,Mn原子的核外电子排布式为[Ar]3d54s2,价电子排布式为:3d54s2,
故答案为:3d54s2;
(2)反应中涉及的属于同主族元素为O、S,同主族自上而下元素第一电离能减小,故第一电离能:O>S,
故答案为:O>S;
(3)①H2S2O8中,硫原子价层电子对数=σ 键电子对+中心原子上的孤电子对=4+$\frac{1}{2}$(6-4-2)=4,所以采取sp3杂化,
故答案为:sp3杂化;
②该反应中,Mn元素的化合价升高(+2→+7),S元素的化合价降低(+7→+6),所以被还原的元素为S,
故答案为:S;
③每生成1mol MnO4-消耗S2O82-为1mol×$\frac{5}{2}$=2.5mol,反应中S2O8 2-中过氧键发生断裂生成SO42-,故断裂2.5NA个非极性键,
故答案为:非极性键,2.5NA;
(4)①每个水分子为3个五边形共用,该结构中水分子数目为$\frac{12×5}{3}$=20,而每个水分子形成3个氢键,每个氢键为1个水分子提供$\frac{1}{2}$,则含有氢键数目为20×3×$\frac{1}{2}$=30,
故答案为:30;
②冰中氢键的作用能为18.8kJ•mol-1,而冰熔化热为5.0kJ•mol-1,说明冰熔化为液态水时只是破坏了一部分氢键,并且液态水中仍在氢键,
故答案为:液态水中仍然存在大量氢键(或冰融化时只破坏了部分氢键);
(5)晶胞中Ti原子数目为8×$\frac{1}{8}$=1、Co原子数目为1、O原子数目为6×$\frac{1}{2}$=3,故化学式为:CoTiO3 ,
故答案为:CoTiO3 ;
(6)铑的某配合物的化学式为CsRh(SO4)2•4H2O,该物质易溶于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成,说明硫酸根处于内界,该盐溶于水的电离方程式为:CsRh(SO4)2•4H2O=Cs++[Rh(SO4)2]-+4H2O,
故答案为:CsRh(SO4)2•4H2O=Cs++[Rh(SO4)2]-+4H2O.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、杂化方式、氢键、晶胞计算、配合物等,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 若混合物为Zn、Al,w不可能是0.1mol | |
| B. | 若混合物为Zn、Fe,w可能大于0.1mol | |
| C. | 若混合物为Fe、Mg,则加入的稀硫酸中溶质质量分数等于9.8% | |
| D. | 若混合物为Cu、Fe,w是0.05mol,则混合物中Fe与Cu的质量比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的正极反应为:O2+2H2O+4e-═4OH- | |
| B. | 该电池的负极反应为:C8H18+25O2--50e-═8CO2↑+9H2O | |
| C. | 电解质的作用是传递电子 | |
| D. | 电池中阴离子向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、CH3COONa、KCl、NH4NO3、NaHSO4 | |
| B. | Na2CO3、CH3COONa、NaHSO4、NH4NO3、KCl | |
| C. | Na2CO3、KCl、NH4NO3、NaHSO4、CH3COONa | |
| D. | Na2CO3、NH4NO3、CH3COONa、NaHSO4、KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在100℃、101 kPa条件下,液态水的气化热为40.69 kJ•mol-1,则H2O(g)?H2O(l) 的△H=40.69 kJ•mol-1 | |||||||||||
| B. | Li、Be、B三种元素的第一电离能(I1)差别不大,而I2差别很大,则三种原子中最难失去第二个电子的是Be | |||||||||||
| C. | 已知:
 的△H为-384 kJ•mol-1 的△H为-384 kJ•mol-1 | |||||||||||
| D. | 固体NH5的所有原子的最外层均满足2个或8个电子的稳定结构,它与水反应的化学方程式为NH5+H2O═NH3•H2O+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有Fe2+,可能有Fe3+ | B. | 只有Fe2+,没有Fe3+和Cu2+ | ||
| C. | 可能有Fe3+,可能有Cu2+ | D. | 肯定有Fe2+,可能有Fe3+、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红的溶液中:Na+、AlO2-、SO42-、Cl- | |
| B. | 含大量OH-的溶液中:HCO3-、Na+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 0.1mol/L NaAlO2溶液:H+、Na+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com