
【题目】某温度下,向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中﹣lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
(已知:Ksp(ZnS)=3×10﹣25mol2/L2)

A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C. 该温度下Ksp(CuS)=10﹣35.4mol2/L2
D. 向100 mLZn2+、Cu2+浓度均为10-5mol/L的混合溶液中逐滴加入10-4mol/L的Na2S溶液,Zn2+先沉淀
【答案】C
【解析】
向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,发生反应:Cu2++S2-![]() CuS↓,Cu2+单独存在或S2-单独存在均会水解,水解促进水的电离,结合图象计算溶度积常数和溶液中的守恒思想,据此判断分析。
CuS↓,Cu2+单独存在或S2-单独存在均会水解,水解促进水的电离,结合图象计算溶度积常数和溶液中的守恒思想,据此判断分析。
向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,发生反应:Cu2++S2-![]() CuS↓,Cu2+单独存在或S2-单独存在均会水解,水解促进水的电离,b点溶液时滴加Na2S溶液的体积是10mL,此时恰好生成CuS沉淀,CuS存在沉淀溶解平衡:CuS(s)
CuS↓,Cu2+单独存在或S2-单独存在均会水解,水解促进水的电离,b点溶液时滴加Na2S溶液的体积是10mL,此时恰好生成CuS沉淀,CuS存在沉淀溶解平衡:CuS(s)![]() Cu2+(aq)+S2-(aq),已知此时-lgc(Cu2+)=17.7,则平衡时c(Cu2+)=c(S2-)=10-17.7mol/L。
Cu2+(aq)+S2-(aq),已知此时-lgc(Cu2+)=17.7,则平衡时c(Cu2+)=c(S2-)=10-17.7mol/L。
A.Cu2+单独存在或S2-单独存在均会水解,水解促进水的电离,b点时恰好形成CuS沉淀,此时水的电离程度并不是a、b、c三点中最大的,A错误;
B.Na2S溶液中,根据物料守恒,2c(S2-)+2c(HS-)+2c(H2S)=c(Na+),B错误;
C.该温度下,平衡时c(Cu2+)=c(S2-)=10-17.7mol/L,则Ksp(CuS)=c(Cu2+) c(S2-)=10-17.7mol/L×10-17.7mol/L=10-35.4mol2/L2,由于已知lg2=0.3,则Ksp(CuS)=10-35.4mol2/L2=(100.3)2×10-36mol2/L2=4×10-36 mol2/L2,C正确;
D.向100 mLZn2+、Cu2+浓度均为10-5mol/L的混合溶液中逐滴加入10-4mol/L的Na2S溶液,产生ZnS时需要的S2-浓度为c(S2-)=![]() 3×10-20mol/L;产生CuS时需要的S2-浓度为c(S2-)=
3×10-20mol/L;产生CuS时需要的S2-浓度为c(S2-)=![]() ×10-31mol/L,则产生CuS沉淀所需S2-浓度更小,优先产生CuS沉淀, D错误;
×10-31mol/L,则产生CuS沉淀所需S2-浓度更小,优先产生CuS沉淀, D错误;
故合理选项是C。


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】LED即发光二极管,是一种能够将电能转化为光能的固态半导体器件。如图是某课外活动小组设计的用化学电源使LED灯发光的装置。下列说法不正确的是

A. 装置中存在“化学能→电能→光能”的转化
B. 铜片上发生的反应为2H++2e-=H2↑
C. 锌片是负极,其质量逐渐减小
D. 如果将稀硫酸换成稀盐酸,则导线中不会有电子流动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组制取氯气并进行氯气的性质实验,其装置如图所示,回答下列问题:
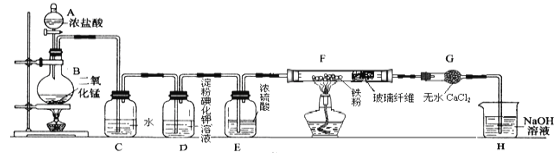
(1)仪器A的名称是 ______,实验中制备氯气的反应方程式为 ____________________。
(2)C中发生反应的化学方程式为 ______ .若将干燥的有色布条放入C中,观察到的现象是 ______,原因是 ___________________________。
(3)实验中观察到D溶液变蓝色,查资料得知淀粉碘化钾溶液是淀粉和碘化钾(KI)的混合溶液,写出D装置中发生反应的离子方程式______________________。
(4)F中氯气与铁粉反应制备无水三氯化铁,查资料知该化合物呈棕红色、易吸水潮解, 100℃左右时升华.双通管F中玻璃纤维(不参与反应)的作用是 ______ ;在F和H装置之间安装G装置的目的是____。
(5)H中NaOH溶液的作用是 _______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①液态氯化氢;②小苏打;③固体纯碱;④二氧化碳;⑤葡萄糖;⑥氢氧化钾;⑦氢氧化铁胶体;⑧氨水;⑨空气;⑩硫酸铁溶液。
(1)上述十种物质中,属于电解质的有_____________,属于非电解质的有_______________。
(2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,该反应的化学方程式为____________________。
(3)除去③中少量②的操作是_______________,化学方程式为_______________________。
(4)现有100 mL⑩溶液中含Fe3+ 5.6g,则溶液中SO42-的物质的量浓度是________________。
(5)若在⑦中缓慢加入①的水溶液,产生的现象是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,密闭容器中发生反应N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ/mol。下列说法正确的是
2NH3(g) △H=-92.4 kJ/mol。下列说法正确的是
A. 将1.0 mol N2、3.0 mol H2置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B. 上述反应达平衡后,若容积不变,再充入1.0 mol氦气,N2的转化率提高
C. 上述反应在达到平衡后,缩小容积增大压强,H2的转化率提高
D. 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z 的原子序数依次增加。m、p、r 是由这些元素组成的二元化合物,n 是元素Z 的单质,通常为黄绿色气体,q 的水溶液具有漂白性,r 溶于水是强酸,s 通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是 ( )

A.W 在周期表中所在族全是金属B.X 的最高价氧化物的水化物为强酸
C.Y 的氢化物常温常压下为气态D.1molZ 单质与氢氧化钠溶液反应转移 1mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素 R、X、T、Z、Q 在元素周期表中的相对位置如图所示,其中 R 的氢化物的水溶液可以用来刻蚀玻璃,则下列判断正确的是( )

A.气态氢化物的酸性:R>T>Q
B.气态氢化物的还原性:X>T
C.R 与 Q 的电子数相差 16
D.R 的单质通入 T 的钠盐溶液中能置换出T 的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A. 定性检验SO![]() ,将BaCl2溶液用HNO3酸化
,将BaCl2溶液用HNO3酸化
B. 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C. 检验溶液中是否含有Fe2+时,用硝酸酸化
D. 检验溶液中是否含有SO![]() 时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液
时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 盐酸的导电能力一定比醋酸的导电能力强
B. 一定量的锌粒与足量稀硫酸反应,向反应混合液中加入醋酸钠固体,产生H2速率减小,H2体积减小
C. 相同温度下,0.1 mol·L-1氨水中NH![]() 的浓度比0.1 mol·L-1 NH4Cl溶液中NH
的浓度比0.1 mol·L-1 NH4Cl溶液中NH![]() 的浓度小
的浓度小
D. 0.1 mol·L-1氨水可以使酚酞试液变红,证明NH3·H2O是弱碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com