
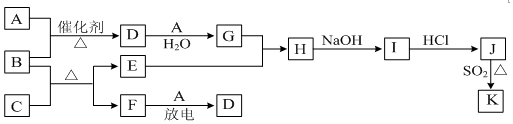
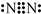
分析 E为红色金属单质,E为Cu,C为黑色氧化物,则C为CuO,B为具有刺激性气味的碱性气体,则B为NH3,A、F为无色气体单质,F与A放电生成D,其A与氨气反应生成D,D与A、水反应生成G,G与Cu反应生成D,可推知F为N2,A为O2,D为NO,G为HNO3,H为Cu(NO3)2,I为Cu(OH)2,J为CuCl2,J、K是同种金属的不同氯化物,K为白色沉淀,应为CuCl,以此解答该题.
解答 解:(1)由以上分析可知D为NO,F为N2,电子式为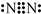 ,故答案为:NO;
,故答案为:NO;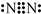 ;
;
(2)B为NH3,可与CuO在在加热条件下发生氧化还原反应生成单质Cu,反应的方程式为3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,反应N元素化合价由-3价升高到0价,则生成1mol氮气,转移6mol电子,
故答案为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;6;
(3)G为HNO3,稀硝酸与铜反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(4)SO2还原CuCl2生成CuCl的离子方程式为2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-,
故答案为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-.
点评 本题考查无机物的推断,为高考常见题型,本题侧重于常见元素化合物知识的考查,注重于物质的工业生成、物理性质的考查,学习中注意牢固把握相关基础知识,题目难度中等.


 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:高中化学 来源: 题型:选择题
| A. | 步骤①,最好用硫酸来溶解烧渣 | |
| B. | 步骤②,涉及的离子反应为FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+ | |
| C. | 步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾 | |
| D. | 步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )| A. | t3 时降低了温度 | |
| B. | t2时加入了催化剂 | |
| C. | t5时增大了压强 | |
| D. | t4~t5时间内 X 或 Y 的转化率最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,20mlNH3与60mlO2所含分子个数比为1:3 | |
| B. | 在化学反应中,1mol金属镁变为镁离子时失去电子数为NA | |
| C. | 在标准状况下,1mol水的体积为22.4L | |
| D. | 2molCaCl2中Cl-的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  蒸馏水 | B. | 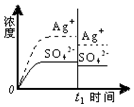 0.010mol•L-1 Ag2SO4溶液 | ||
| C. | 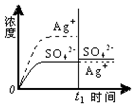 0.020mol•L-1 Na2SO4溶液 | D. | 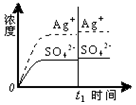 0.040mol•L-1 AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5s时,正、逆反应速率都达到最大 | |
| B. | 前5s内平均反应速率υ(Y)=0.1 mol/( L•s) | |
| C. | 达平衡时,各物质的浓度都保持不变,反应停止 | |
| D. | 升高温度,测得容器中密度不变时,表示该反应已经达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的摩尔质量等于其相对原子质量或相对分子质量 | |
| B. | 摩尔是7个基本物理量之一 | |
| C. | 46 g NO2和N2O4的混合物中含有的氮原子数为NA | |
| D. | 1molCO2所占的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失 | |
| B. | 在加入铝粉能放出氢气的溶液中:K+、NH4+、NO3-、Cl-一定能够大量共存 | |
| C. | 利用食醋除去热水瓶水垢中CaCO3的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 除去乙酸乙酯中的少量乙酸:加入过量的NaOH溶液,静置分层后,除去水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由被氧化的元素组成的反应物是氧化剂 | |
| B. | 在一个氧化还原反应中,氧化反应和还原反应同时发生 | |
| C. | 由化合态转变为游离态的变化一定是还原反应 | |
| D. | 氧化还原反应的实质是元素化合价的升降 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com