
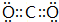 .
. .
. 分析 X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,则X原子核外电子数为6,故X为碳元素;Z原子L层上有2对成对电子,则Z原子核外电子排布为1s22s22p4,故Z为氧元素;Y原子序数介于碳元素与氧元素之间,故Y为氮元素;Q是第三周期中电负性最大的元素,Q为Cl元素;E+的M层3d轨道电子全充满,则其核外电子数为2+8+18+1=29,故E为Cu,据此解答.
解答 解:X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,则X原子核外电子数为6,故X为碳元素;Z原子L层上有2对成对电子,则Z原子核外电子排布为1s22s22p4,故Z为氧元素;Y原子序数介于碳元素与氧元素之间,故Y为氮元素;Q是第三周期中电负性最大的元素,Q为Cl元素;E+的M层3d轨道电子全充满,则其核外电子数为2+8+18+1=29,故E为Cu.
(1)CO2分子结构式为O=C=O,双键中含有1个σ键、1个π键,故CO2分子中含有2个σ键、2个π键,电子式为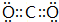 ,
,
故答案为:2、2;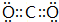 ;
;
(2)同周期自左而右第一电离能呈增大趋势,但氮原子2p能级有3个电子,处于半满稳定状态,能量降低,失去电子需要能量较高,故N元素的第一电离能高于同周期相邻元素,故第一电离能C<O<N,
故答案为:C;O;N;
(3)氧元素的电负性很强,H2O分子间能形成氢键,HCl分子间不能形成氢键,氢键比分子间作用力强,故水的沸点高于HCl,
故答案为:H2O分子间能形成氢键,HCl分子间不能形成氢键;
(4)E为Cu元素,基态原子的电子排布式为:ls22s22p63s23p63d104s1,
故答案为:ls22s22p63s23p63d104s1;
(5)Cu2+能与NH3形成配合物离子,NH3含有孤电子对,提供孤对电子,Cu2+含有空轨道,接受孤对电子,配合物离子[Cu(NH3)4]2+中的配位键为 ,
,
故答案为: .
.
点评 本题是对物质结构与性质的考查,涉及核外电子排布规律、电离能、化学键与氢键、配合物等,难度中等,注意配合物中配位键的表示.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
| A. | 豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间 | |
| B. | NaCl溶液是电解质,因为NaCl溶液能导电 | |
| C. | Na和H2O的反应不是离子反应,因为反应中没有离子参加 | |
| D. | H2SO4是酸,因为H2SO4中含有氢元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| A | B | C | D | |
| 物质 | 煤油 | 丙醇 | 四氯化碳 | 乙醚 |
| 沸点/℃ | 180~310℃ | 97.4 | 76.5 | 34.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用明矾作净水剂 | B. | 用硫磺粉处理散落在地上的汞 | ||
| C. | 用食醋清洗水壶中的水垢 | D. | 服用复方氢氧化铝片治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol N2所含有的原子数为NA | |
| B. | 1mol•L-1 NaCl溶液中含有的钠离子数目为NA | |
| C. | 标准状况下,22.4 LCO所含的原子数为NA | |
| D. | 12.4g白磷(分子式为P4)中含有磷原子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的说法中正确的是( )
的说法中正确的是( )| A. | 在浓硫酸作用下可水解成相应的醇 | |
| B. | 滴加AgNO3溶液可产生白色沉淀 | |
| C. | 该卤代烃发生消去反应只能生成一种烯烃 | |
| D. | 该卤代烃经过消去、加成、消去只能生成一种烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①最多 | B. | ③最多 | C. | 一样多 | D. | 无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com