
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向Fe(NO3)3溶液中通入SO2,滴加BaCl2溶液; 产生白色沉淀 | NO3-在酸性条件下能氧化SO2生成SO42- |
| B | 向Fe(NO3)2溶液中滴加少量盐酸; 浅绿色变深绿色 | 溶液中存在Fe2+水解平衡移动 |
| C | 向沸水中滴加FeCl3饱和溶液,煮沸得红褐色液体;用激光灯照射液体,有一条明亮“通路” | 该液体分散质直径介于1nm与100nm之间 |
| D | 向FeI2溶液中滴加酸化的双氧水和淀粉溶液;溶液为蓝色 | Fe2+的还原性比I-的还原性弱 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.酸性条件下,硝酸根离子、铁离子都具有强氧化性;
B.酸性条件下,Fe2+被NO3-氧化生成Fe3+;
C.胶体具有丁达尔效应,胶体分散质粒子直径在1-100nm之间;
D.在氧化还原反应中,还原性强的微粒先被氧化.
解答 解:A.酸性条件下,硝酸根离子、铁离子都具有强氧化性,都能氧化二氧化硫生成硫酸根离子,故A正确;
B.酸性条件下,Fe2+被NO3-氧化生成Fe3+,导致溶液由浅绿色变为黄色,与亚铁离子水解无关,故B错误;
C.胶体具有丁达尔效应,胶体分散质粒子直径在1-100nm之间,该实验现象说明得到的液体是胶体,其微粒直径在1-100nm之间,故C正确;
D.在氧化还原反应中,还原性强的微粒先被氧化,该实验现象说明生成碘,则说明Fe2+的还原性比I-的还原性弱,故D正确;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及还原性强弱判断、胶体性质、盐类水解等知识点,明确实验原理及物质性质是解本题关键,注意D中离子还原性强弱顺序,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:实验题
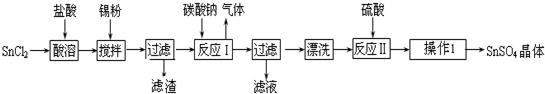
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
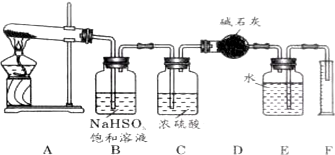
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其它条件不变时,升高温度,可以提高反应物的活化分子百分数 | |
| B. | 其它条件不变时,增大反应物的浓度,可以提高反应物的活化分子百分数 | |
| C. | 保持温度不变,化学平衡正向移动时,化学平衡常数增大,逆向移动时则减小 | |
| D. | 其它条件不变时,加入高效催化剂,可以增大化学反应速率和反应物的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向煤中加入适量CaO,可大大减少燃烧产物中SO2的量 | |
| B. | 葡萄酒中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ②③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③⑤ | C. | ①②⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 脱氧过程是吸热反应,可降低温度,延长糕点保质期 | |
| B. | 脱氧过程中铁作原电池正极,电极反应为:Fe-3e-=Fe3+ | |
| C. | 脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-═4OH- | |
| D. | 含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com