
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(1)Cu+基态核外电子排布式为
(2)与OH-互为等电子体的一种分子为 (填化学式)。
(3)醛基中碳原子的轨道杂化类型是 ;1mol乙醛分子中含有ó的键的数目为 。
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为 。
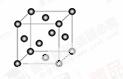
(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为 。
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
右图模 拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是
拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是
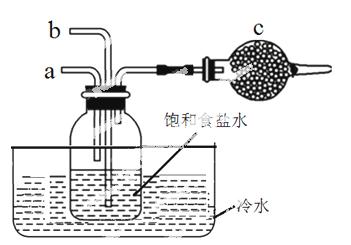
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.b通入NH3,然后a通入CO2,c中放碱石灰
C.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)①BF3与一定量的水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
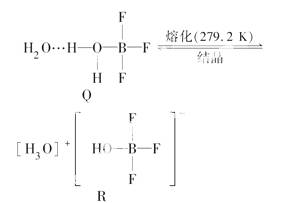
晶体Q中各种微粒间的作用力不涉及________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②已知苯酚具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子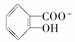 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是__________________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是__________________。
(2)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
| 键能/ (kJ·mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是______________________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
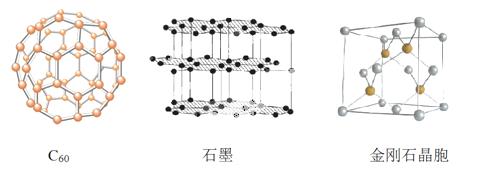
回答下列问题:
(1)金刚石、石墨、C60 .碳纳米管等都是碳元素的单质形式,它们互为_____________。
.碳纳米管等都是碳元素的单质形式,它们互为_____________。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为____、____。
(3)C60属于____晶体,石墨属于____晶体。
(4)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C-C间的____共价键,而石墨层内的C-C间不仅存在____共价键,还有____键。
(5)金刚石晶胞含有____个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬 球接触模型,则r= ______a,列式表示碳原子在晶胞中的空间占有率____(不要求计算结果)。
球接触模型,则r= ______a,列式表示碳原子在晶胞中的空间占有率____(不要求计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为 ,该元素的符号是 。
(2)Y元素原子的电子排布图为 ,元素X与Y的电负性比较:X Y(填“>”或“<”)。
(3)X与Z可形成化合物XZ3,该化合物的空间构型为 。
(4)由元素X与镓元素组成的化合物A为第三代半导体。已知化合物A的晶胞结构如图所示。(黑球位于立方体内,白球位于立方体顶点和面心)
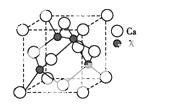
请写出化合物A的化学式 ;化合物A可由(CH3)3Ga和AsH3在700 ℃下反应制得,反应的化学方程式为 。
(5)已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是常见的不同主族的短周期元素,它们的原子序数逐渐增大。已知其中只有一种是金属元素,C元素原子最外层电子数是D元素原子的最外层电子数的一半,B元素原子的最外层电子数比D元素原子的最外层电子数少2个。E、F也是短周期元素,E与D同主族,F与A同主族。
(1)写出F2E2的电子式:_____________________,
其晶体类型为________,其化学键类型为____________________。
(2)E与D各自形成的氢化物中沸点较高的是____ ____(填化学式),其原因是___________________________,
____(填化学式),其原因是___________________________,
A与B所形成最简单化合物的结构式为________,空间构型为________。
(3)六种元素中的三种组成的易溶于水的酸性物质中,能促进水电离的物质M是___________________
(写化学式,写一个 即可,下同),能抑制水电离的物质N是________。
即可,下同),能抑制水电离的物质N是________。
25 ℃时,pH=a的M溶液中由水电离出的H+浓度与pH=a的N溶液中由水电离出的H+浓度之比为________。
(4)甲、乙、丙分别是B、C、D三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙的用量不同,反应的产物不同。回答下列问题:
①向乙溶液中缓慢滴加过量的丙溶液,过程中发生反应的离子方程式为___________________。
②向甲溶液中缓慢滴加过量的丙溶液,所观察到的实验现象为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在P+CuSO4+H2O—→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 mol CuSO4可氧化P的物质的量为________mol。生成1 mol Cu3P时,参加反应的P的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
超导体是具有零电阻及反磁性的物质,以Y2O3、BaCO3及CuO为原料,经研细烧结可合成一高温超导物质YBa2Cu3Ox。现欲合成0.5 mol此高温超导体,依化学剂量比例需要Y2O3______mol,CuO______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com