
| A. | ①②③④ | B. | ①②④ | C. | ①④ | D. | ②④ |
分析 设所给物质的通式为CxHyOz,则其燃烧方程式为:CxHyOz+(x+$\frac{y}{4}$-$\frac{z}{2}$)O2$\frac{\underline{\;加热\;}}{\;}$xCO2+$\frac{y}{2}$H2O,
所以1mol物质消耗氧气的量多少取决于(x+$\frac{y}{4}$-$\frac{z}{2}$),据此解答.
解答 解:①1molC2H2 完全燃烧消耗氧气的物质的量为2+$\frac{2}{4}$=2.5;1molCH3CHO完全燃烧消耗氧气的物质的量为2+$\frac{4}{4}$-$\frac{1}{2}$=2.5;二者相等,故选;
②1moC7H8完全燃烧消耗氧气的物质的量为7+$\frac{8}{4}$=9;与1molC6H12 完全燃烧消耗氧气的物质的量为6+$\frac{12}{4}$=9;二者相等,故选;
1moC2H2完全燃烧消耗氧气的物质的量为2+$\frac{2}{4}$=2.5;与1molC6H6完全燃烧消耗氧气的物质的量为6+$\frac{6}{4}$=7.5;二者不相等,故不选;
1moHCOOCH3完全燃烧消耗氧气的物质的量为2+$\frac{4}{4}$-1=2;与1molCH3COOH完全燃烧消耗氧气的物质的量为2+$\frac{4}{4}$-1=2;二者相等,故选;
故选:B.
点评 本题考查了烃及其含氧衍生物燃烧的耗氧量,明确烃及其含氧衍生物燃烧通式是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
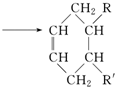 (可表示为
(可表示为 )其中,R、R′表示原子或原子团.
)其中,R、R′表示原子或原子团.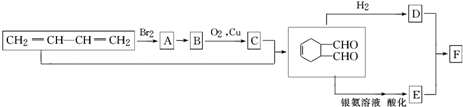
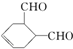 中官能团的名称是醛基.1mol该物质完全燃烧需消耗O26.5mol
中官能团的名称是醛基.1mol该物质完全燃烧需消耗O26.5mol .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 此元素有三种同位素 | |
| B. | 其中质量数为79的同位素原子占原子总数 $\frac{1}{2}$ | |
| C. | 其中一种同位素质量数为80 | |
| D. | 此元素单质的平均相对分子质量为160 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z可以电离 | B. | Z可以表示为:XY2 | C. | X形成+2价阳离子 | D. | Z的电子式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
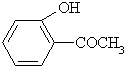 乙:
乙: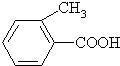 丙:
丙: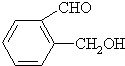
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 由图中信息可知HA为强酸,N点表示酸碱恰好中和 | |
| B. | 常温下,一定浓度的MA稀溶液的pH<7 | |
| C. | K点所对应的溶液中离子浓度的大小关系:c(M+)>c(OH-)>c(A-)>c(H+) | |
| D. | K点对应的溶液中,溶液的pH>13.c(HA)+c(A-)=0.25mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com