
甲、乙、丙、丁是四种短周期元素,乙原子中K层与M层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
(1)甲的单质与水反应的离子方程式为 ;
(2)乙元素在周期表中的位置为 ;
(3)丙元素的最高价氧化物的电子式为 ;
(4)甲与丁两种元素可组成的具有强氧化性的物质是 。(填化学式)
(8分)(1)2Na+2H2O=2Na++H2↑ ⑵ 第二周期ⅡA族 ⑶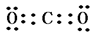 ⑷ Na2O2
⑷ Na2O2
解析试题分析:乙原子中K层与M层电子数相等,所以乙是Mg。甲原子的核外电子数比乙原子核外电子数少1,则甲是钠元素。丙原子的最外层电子数是次外层电子数的2倍,因此丙是碳元素。丁原子核电荷数比丙原子核电荷数多2,所以丁是氧元素。
(1)钠是活泼的金属,极易和水反应生成氢氧化钠和氢气,反应的化学方程式是2Na+2H2O=2Na++H2↑。
(2)镁是12号元素,位于元素周期表的第二周期ⅡA族。
(3)碳元素的最高价氧化物是CO2,含有极性键的共价化合物,电子式是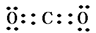 。
。
(4)钠和氧元素形成的具有强氧化性的物质是过氧化钠,化学式是Na2O2。
考点:考查元素周期表第结构和元素周期律的应用以及常见化学用语的书写
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:填空题
现有部分短周期主族元素的有关信息,如下表:
| 元素编号 | T | X | Y | Z | W |
| 元素的性质或原子结构情况 | 短周期主族元素中原子半径最大 | 最外层上的电子数比次外层少1个且单质是气体 | 核外共有13种运动状态不同的电子 | 若低温蒸发液态空气,因其沸点较低可先获得它的单质 | 核外有5种不同能量的电子且其中有两个未成对的电子 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
CaC2可用于固氮:CaC2+N2  CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式: 。
(2)C、N、O三种元素的第一电离能由小到大的顺序是 。
(3)NH3中N原子的杂化方式为 ;根据价层电子对互斥理论推测CO32-的空间构型为 。
(4)CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有 (填写一种化学式即可);写出CaCN2水解反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有原子序数依次增大的五种短周期元素A、B、C、D、E,已知 A、E同主族,A在所有元素中原子结构最简单,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y;A、B、C、E四种元素都能与D元素分别形成原子个数比不相同的常见化合物,回答下列问题:
(1)B在周期表中的位置是 ,E的原子结构示意图 。
(2)A与C形成化合物中含有的化学键属于(填“极性键”或“非极性键”) 。
(3)用电子式表示化合物E2D的形成过程 。
(4)C元素的最高价氧化物的水化物与其氢化物反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有几种元素的微粒的核外电子层结构如图所示。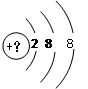
请回答下列问题。
(1)若该微粒是中性微粒,这种微粒的符号是_____________。
(2)若该微粒的盐溶液能使溴水退色,并出现浑浊,这种微粒的符号是____________。
(3)若该微粒的氧化性很弱,得到1个电子后变为原子,其单质的还原性很强,这种微粒的符号是________________。
(4)若该微粒的还原性很弱,失去1个电子后变为原子,其单质的氧化性很强,这种微粒的符号是_______________
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(12分)下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | | | ⑦ | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)现有5种短周期元素A、B、C、D、E,原子序数依次增大。A的同位素中有一种核素无中子,B最外层上电子数是次外层电子数的两倍,C元素最简单的氢化物Y的水溶液呈碱性,E是短周期中电负性最小的元素。D与可与A、B、C、E四种元素分别形成原子个数比不相同的常见化合物。回答下列问题:
(1)写出A、E两元素形成的原子个数比为1:1的化合物的电子式 。
(2)CS2和B、D元素形成的一种化合物为等电子体,则CS2的分子结构为 ,1molCS2中含有的π键为 个。
(3)Y的中心原子的杂化轨道类型为 ,分子的立体构型为 。
(4)由A、B、D、E形成的化合物W、Z,其中W由三种元素组成,Z由四种元素组成,水溶液物显碱性,用离子方程式表示Z溶液显碱性的原因 。等浓度,等体积的W,Z的混合溶液中,离子浓度由大到小的顺序为 。
(5)有一种氮化钛晶体的晶胞如图所示,钛原子的电子排布式为 ,该氮化钛的化学式为 ,氮原子的配位数为 。晶胞中N、Ti之间的最近距离为apm,则氮化钛的密度为 g.cm3(NA为阿佛加德罗常数值,只列式计算)。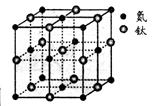
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(15分)W、M、N、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数的变化如右图所示,已知W的一种同位素的质量数为18,中子数为10;M和Ne原子的核外电子数相差1;N与X相邻,N的单质是日常生活中常用的金属材料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最强。
(1)W的另一种同位素的质子数与中子数相等,原子符号表示为 ;元素Y在周期表中的位置是 。
(2)下列有关物质性质的比较中,正确的是 (填字母编号)。
| A.W、X、Y三种元素最简单氢化物的稳定性:W>Y>X |
| B.M、X、Z三种元素形成的单质熔点:X>M>Z |
| C.Y、Z两种元素的含氧酸酸性:Z>Y |
| D.Y、Z两种元素的单核阴离子还原性:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学生在做元素性质与原子结构关系的实验时,设计了一套实验方案,并记录了有关的实验现象。请帮助该学生整理并完成实验报告。
(1)实验目的
探究同一主族元素性质的递变规律。
(2)实验用品
仪器:试管、胶头滴管
药品:新制氯水、新制溴水、溴化钠溶液、碘化钠溶液、四氯化碳
(3)实验内容(在下表横线中填写相关内容)
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈_____色 |
| ② | 向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈_____色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com