
| A. | x+y>z | B. | 平衡向正反应方向移动 | ||
| C. | B 的转化率升高 | D. | C 的体积分数增加 |
分析 反应xA(g)+yB(g)?zC(g)在平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,若平衡不移动,A的浓度为0.25mol/L,而再达平衡时测得A的浓度为0.30mol/L,说明体积增大(压强减小)化学平衡逆向移动,则x+y>z,据此结合化学平衡的影响因素进行解答.
解答 解:由信息可知,平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时测得A的浓度为0.30mol/L,体积增大,相当于压强减小,化学平衡逆向移动,则x+y>z,
A.减小压强,向气体体积增大的方向移动,则x+y>z,故A正确;
B.由上述分析可知,平衡逆向移动,故B错误;
C.平衡逆向移动,B的转化率降低,故C错误;
D.平衡逆向移动,C的体积分数减小,故D错误;
故选A.
点评 本题考查化学平衡及其影响,题目难度不大,明确A的浓度变化及体积变化导致的平衡移动是解答本题的关键,注意熟练掌握影响化学平衡的因素,试题培养了学生的灵活应用能力.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | 1molFeCl3水解生成的Fe(OH)3胶粒数为1NA | |
| B. | 4.6g有机物C2H6O的分子结构中含有的C-H键数目一定为0.5NA | |
| C. | 标准状况下,11.2LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 1mol•L-1AlCl3溶液中含有3NA个Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
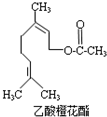 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )| A. | ①②③ | B. | ①②⑤ | C. | ②④⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH4(g)+H2O(g)△H=-203kJ•mol-1.
CH4(g)+H2O(g)△H=-203kJ•mol-1.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫离子的结构示意图: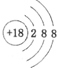 | B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | 电子转移情况: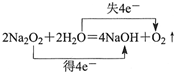 | D. | 氮分子的结构式:N≡N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 所有需要加热的化学反应都是吸热反应 | |
| C. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 | |
| D. | 开发利用可燃冰是缓解能源紧缺的唯一途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①④⑥ | C. | ②③⑤ | D. | ②③⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com