
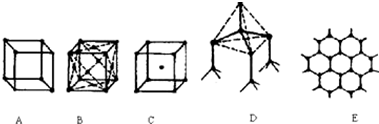
分析 (1)在金刚石晶胞中,每个碳可与周围四个碳原子形成共价键,将这四个碳原子连结起来后可以形成正四面体,体心有一个碳原子,金刚石是原子晶体,据此判断;
(2)石墨是层状结构,在层与层之间以范德华力相互作用,在层内碳与碳以共价键相互作用,形成六边形,其中每个正六边形占有的碳原子数平均为6×$\frac{1}{3}$=2,据此答题;
(3)干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上,据此答题;
(4)原子晶体>分子晶体,石墨是层状结构,C原子sp2杂化,与3个C原子形成σ键,未杂化的1个p轨道形成大π键,金刚石,是空间网状结构,C原子sp3杂化,与4个C原子成键,sp2杂化中,s轨道的成分比sp3杂化更多,所以形成的共价键更短,更牢固;
(5)根据含氧酸的强度随着分子中连接在中心原子上的非羟基氧的个数增大而增大分析.
解答 解:(1)在金刚石晶胞中,每个碳可与周围四个碳原子形成共价键,将这四个碳原子连结起来后可以形成正四面体,体心有一个碳原子,所以图D为金刚石,每个碳原子与四个碳原子最近且距离相等,金刚石属于原子晶体,
故答案为:D,4;原子;
(2)石墨是层状结构,在层与层之间以范德华力相互作用,有分子晶体的特点,在层内碳与碳以共价键相互作用,形成六边形,有原子晶体的特点,所以图E为石墨的结构,为混合晶体,其中每个正六边形占有的碳原子数平均为6×$\frac{1}{3}$=2,
故答案为:E;2;
(3)干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上,所以图B为干冰晶体,
故答案为:B;分子;12;
(4)石墨是层状结构,C原子sp2杂化,与3个C原子形成σ键,未杂化的1个p轨道形成大π键,金刚石,是空间网状结构,C原子sp3杂化,与4个C原子成键,sp2杂化中,s轨道的成分比sp3杂化更多,所以形成的共价键更短,更牢固,即石墨的层内共价键键长比金刚石的键长短,作用力更大,破坏化学键需要更大能量,所以石墨的熔点比金刚石高,干冰是分子晶体,熔点最低,
故答案为:石墨>金刚石>干冰;
(5)含氧酸的强度随着分子中连接在中心原子上的非羟基氧的个数增大而增大,即(HO)mROn中,n值越大,酸性越强,
故答案为:强.
点评 本题主要考查了各种类型的晶胞的结构及配位数,难度中等,解题是要能熟记常见的各种类型的晶胞结构图,明确石墨晶体和金刚石晶体的熔点的比较方法.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案科目:高中化学 来源: 题型:选择题
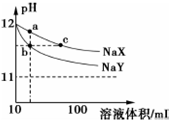 常温下,体积均为10mL、pH均为12的NaX和NaY两种钠盐溶液,分别加水稀释,pH随溶液体积的变化如图所示.下列叙述错误的是( )
常温下,体积均为10mL、pH均为12的NaX和NaY两种钠盐溶液,分别加水稀释,pH随溶液体积的变化如图所示.下列叙述错误的是( )| A. | 相同温度下,电离平衡常K(HX)<K(HY) | |
| B. | b、c两点溶液中水的电离程度相同 | |
| C. | a点溶液中:c(H+)+c(HX)=c(OH-) | |
| D. | b、c两点溶液中Na+的物质的量:nb(Na+)<nc(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍的原子失电子能力比镁弱 | |
| B. | Tl(OH)3 和Al(OH)3一样都属于两性氢氧化物 | |
| C. | 硫化氢比硒化氢稳定 | |
| D. | 锂与氧气在点燃的条件下生成氧化锂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2+ (过氧乙酸)→ (过氧乙酸)→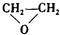 +CH3COOH +CH3COOH | |
| B. | CH2═CH2+Ca(OH)2→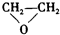 +CaCl2+H2O +CaCl2+H2O | |
| C. | 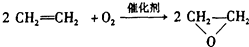 | |
| D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
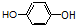 酚类;
酚类; 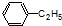 烃(或芳香烃);
烃(或芳香烃);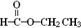 酯(或酯类);
酯(或酯类); 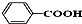 酸类(或芳香酸).
酸类(或芳香酸).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于90% | B. | 等于90% | C. | 大于90% | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
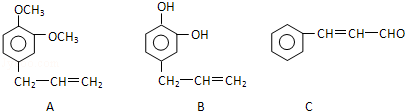
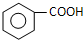 +
+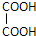 则C9H8O的结构简式为
则C9H8O的结构简式为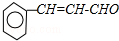 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com