
【题目】工业上常以烃的含氧衍生物X为主要原料生产可降解塑料PCL{![]() }及阻燃剂四溴双酚A.合成线路如下:
}及阻燃剂四溴双酚A.合成线路如下:
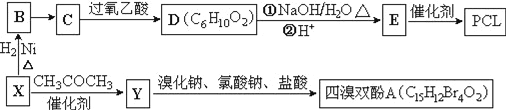
已知:①X的蒸汽密度是相同条件下H2的47倍,遇FeCl3溶液显紫色;C为![]() 。
。
②![]() 。
。
③RCOCH2R′![]() RCOOCH2R′。
RCOOCH2R′。
(1)B的名称是_________________。
(2)B→C还需要的反应试剂及条件是___________。C→D的反应类型是______________________。
(3)写出X→Y的化学方程式:_______________________________。
(4)0.5mol四溴双酚A在一定条件下与足量的NaOH溶液反应,最多消耗__molNaOH。
(5)符合以下条件的D的同分异构体有__种(不考虑空间异构)。
①含有两个甲基和两种官能团 ②能使溴的CCl4溶液褪色 ③能发生银镜反应
(6)已知由烯烃直接制备不饱和酯的新方法为:
![]()
利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料![]() ,写出合成该涂料的反应流程图:________________________________。
,写出合成该涂料的反应流程图:________________________________。
【答案】 环己醇 O2、Cu、加热 氧化反应 ![]() 5 10
5 10 ![]()
【解析】由已知①X的蒸汽密度是相同条件下H2的47倍,则X相对分子质量为94,遇FeCl3溶液显紫色,说明含有酚羟基,所以X为![]() ;X和氢气发生加成反应生成B,则B为
;X和氢气发生加成反应生成B,则B为![]() ;C为
;C为![]() ,则B发生催化氧化生成C,PCL{
,则B发生催化氧化生成C,PCL{![]() }为E发生缩聚反应产物,则E结构简式为HO(CH2)5COOH,D发生水解反应后酸化得到E,则D结构简式为
}为E发生缩聚反应产物,则E结构简式为HO(CH2)5COOH,D发生水解反应后酸化得到E,则D结构简式为![]() ;由已知②,X(
;由已知②,X(![]() )和丙酮发生取代反应生成Y,则Y的结构简式为
)和丙酮发生取代反应生成Y,则Y的结构简式为![]() ,四溴双酚A结构简式为
,四溴双酚A结构简式为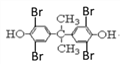 。
。
(1)B为![]() ,名称为:环己醇。
,名称为:环己醇。
(2)B(![]() )发生催化氧化生成C(
)发生催化氧化生成C(![]() ),所以B→C还需要的反应试剂及条件是:O2、Cu、加热;由已知③可得,C(
),所以B→C还需要的反应试剂及条件是:O2、Cu、加热;由已知③可得,C(![]() )生成D(
)生成D(![]() )的反应是氧化反应。
)的反应是氧化反应。
(3)X(![]() )和丙酮发生取代反应生成Y(
)和丙酮发生取代反应生成Y(![]() ),化学方程式为:2
),化学方程式为:2![]() +
+![]()
![]()
![]() +H2O。
+H2O。
(4)四溴双酚A( )能和
)能和
(5)D结构简式为![]() ,符合下列条件的D的同分异构体:①含有两个甲基和两种官能团,则官能团为醛基和羟基或碳碳双键和
,符合下列条件的D的同分异构体:①含有两个甲基和两种官能团,则官能团为醛基和羟基或碳碳双键和![]() (羧基或酯基);②能使溴的CCl4溶液褪色,则含碳碳双键;③能发生银镜反应说明含有醛基。综合以上三点,符合条件的D的同分异构体应为甲酸酯,有:HCOOCH=CHCH(CH3)2、HCOOCH=C(CH3)CH2CH3、HCOOC(CH3)=CHCH2CH3、HCOOC(CH3)=C(CH3)CH3、HCOOC(CH2CH3)=CHCH3、HCOOCH2CH=C(CH3)2、HCOOCH(CH3)CH=CHCH3、HCOOCH2C(CH3)=CHCH3、HCOOC(CH3)2CH=CH2、HCOOCH(CH3)C(CH3)=CH2,共10种。
(羧基或酯基);②能使溴的CCl4溶液褪色,则含碳碳双键;③能发生银镜反应说明含有醛基。综合以上三点,符合条件的D的同分异构体应为甲酸酯,有:HCOOCH=CHCH(CH3)2、HCOOCH=C(CH3)CH2CH3、HCOOC(CH3)=CHCH2CH3、HCOOC(CH3)=C(CH3)CH3、HCOOC(CH2CH3)=CHCH3、HCOOCH2CH=C(CH3)2、HCOOCH(CH3)CH=CHCH3、HCOOCH2C(CH3)=CHCH3、HCOOC(CH3)2CH=CH2、HCOOCH(CH3)C(CH3)=CH2,共10种。
(6)用逆推法分析:可用CH2=CHCOOCH2CH3发生加聚反应生成![]() ;由已知得到启发,可用CH2=CH2、CH3CH2OH、CO和O2反应生成CH2=CHCOOCH2CH3;一定条件下乙烯和水发生加成反应生成CH3CH2OH,所以利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料
;由已知得到启发,可用CH2=CH2、CH3CH2OH、CO和O2反应生成CH2=CHCOOCH2CH3;一定条件下乙烯和水发生加成反应生成CH3CH2OH,所以利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料![]() 的流程图为:
的流程图为:![]() 。
。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.对于有气体参与的反应,增大压强,活化分子总数增多,化学反应速率增大
B.对放热反应而言,升高温度,活化分子百分数减少,化学反应速率减小
C.活化分子间发生的碰撞为有效碰撞
D.使用催化剂,活化分子百分数增多,化学反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 多年前,一艘载着天然苏打晶体(Na2CO3·10H2O)的商船在航行中搁浅,船员们便在附近的沙滩上用几块苏打晶体支锅煮饭。之后他们惊奇地发现,在苏打与沙粒接触的地方出现了许多晶莹发亮的珠子。回答下列问题:
(1)沙滩上沙粒的主要成分为_______(填化学式)。
(2)上述晶莹发亮的珠子可能是______(填字母)。
A. 水晶颗粒 B.无水碳酸钠 C.晶体硅 D.玻璃珠
(3)生成该珠子时发生反应的化学方程式为_____________。
(4)氢氟酸常用作玻璃的蚀刻剂,原因是______________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室进行硫的化合物系列实验。
Ⅰ.验证H2SO3的酸性比H2CO3强,甲同学设计下图装置。

(1)试剂X的作用是_______。
(2)当观察到_______,即证明H2SO3的酸性比H2CO3强。
Ⅱ.研究铁与硫酸的反应。
已知: 浓H2SO4的沸点为338.2℃。
a.乙同学设计如下表所示的实验1、2:
实验 | 试剂 | 现象 | |
| 1 | 螺旋状铁丝、稀硫酸 | 铁丝表面有大量气体产生。 |
2 | 螺旋状铁丝、浓硫酸 | 铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止。 | |
(3)上述实验中,铁丝绕成螺旋状的目的是_______。
(4)实验1中,铁与稀硫酸反应的离子方程式为_______。
(5)实险2中的现象常被称为_______。
b.丙同学设计如图所示装置的实验3:
加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体,实验结束后,检验到A的溶液中既有Fe3+又有Fe2+。
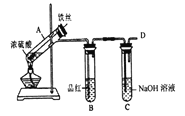
(6)A中产生的气体是_______; 请设计实验方案检测装置A的溶液中含有Fe3+_______ (简要说明操作、试剂、现象和结论)。
(7)分析实验1、2、3,可知影响铁和硫酸反应产物多样性的因素有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质按酸、碱、盐分类排列,正确的是( )
A. 硫酸 纯碱 硫酸钙 B. 盐酸 烧碱 硫酸亚铁
C. 碳酸 乙醇 烧碱 D. 磷酸 熟石灰 苛性钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)△H=a kJ/mol 在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:下列说法不正确的是( )
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
A.10 min内,T1时CH4的化学反应速率比T2时小
B.温度:T1<T2
C.a<0
D.平衡常数:K(T1)<K(T2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式H+ + OH-= H2O可表示的化学方程式是( )
A. 盐酸与氢氧化铜的反应 B. 硫酸氢钠与氢氧化钠的反应
C. 硫酸与氢氧化镁的反应 D. 盐酸与氨水的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com