
| A. | 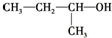 2-甲基-1-丙醇 | B. | 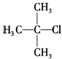 2-甲基-2-氯丙烷 | C. | 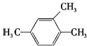 1,3,4-三甲苯 | D. | 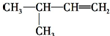 2-甲基-3-丁烯 |
分析 A、醇命名时,要选含官能团的最长的碳链为主链,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置;
B、卤代烃命名时,要选含官能团的最长的碳链为主链,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置;
C、苯的同系物在命名时,从简单的侧链开始按顺时针或逆时针给主链上的碳原子进行编号,使侧链的位次和最小;
D、烯烃命名时,要选含官能团的最长的碳链为主链,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置.
解答 解:A、醇命名时,要选含官能团的最长的碳链为主链,故主链上有4个碳原子,称为丁醇,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置,故-OH在2号碳原子上,则名称为2-丁醇,故A错误;
B、卤代烃命名时,要选含官能团的最长的碳链为主链,故主链上有3个碳原子,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置,故在2号碳原子上有一个甲基和一个-Cl,故名称为:2-甲基-2-氯丙烷,故B正确;
C、苯的同系物在命名时,从简单的侧链开始按顺时针或逆时针给主链上的碳原子进行编号,使侧链的位次和最小,故分别在1、2、4号碳原子上各有一个甲基,故名称为:1,2,4-三甲苯,故C错误;
D、烯烃命名时,要选含官能团的最长的碳链为主链,故主链上有4个碳原子,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置,故在1号和2号碳原子间有双键,在3号碳原子上有一个甲基,故名称为:3-甲基-1-丁烯,故D错误;
故选B.
点评 本题考查了醇、卤代烃、苯的同系物和烯烃的命名,应注意的是含官能团的有机物命名时,要一切以官能团为对象来考虑.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:选择题
| A. | 石墨 | B. | 石英 | C. | 锗 | D. | 硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;E的分子式为C10H12O2;F中含氧官能团的名称是酯基、醛基.
;E的分子式为C10H12O2;F中含氧官能团的名称是酯基、醛基. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加成反应,消去反应,取代反应 | B. | 消去反应,加成反应,取代反应 | ||
| C. | 取代反应,消去反应,加成反应 | D. | 取代反应,加成反应,消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:回答下列问题:
(具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:回答下列问题: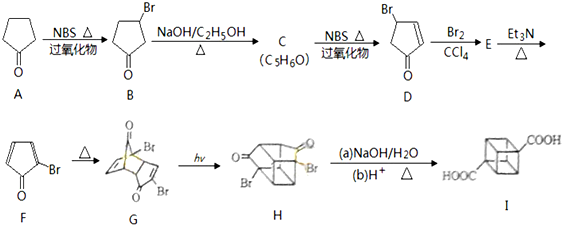
 ,E的结构简式为
,E的结构简式为 .
.
 :反应3可用的试剂为O2/Cu.
:反应3可用的试剂为O2/Cu.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
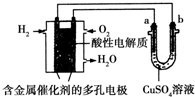
| A. | 此装置用于铁表面镀铜时,a为铁 | |
| B. | 此装置用于电镀铜时,硫酸铜溶液的浓度减小 | |
| C. | 燃料电池中正极反应为$\frac{1}{2}$O2+2e-+H2O═2OH- | |
| D. | 若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 室温下,试管中所加试剂及用量/mL | 室温下,溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L H2SO4溶液 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
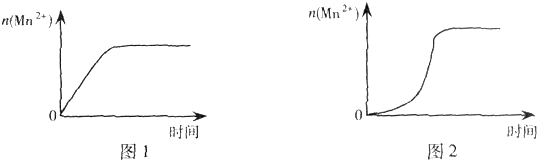
| 实验 编号 | 室温下,试管中所加试剂及用量/mL | 再向试管中加入少量固体 | 室温下,溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L H2SO4溶液 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com