
【题目】半导体有单质、二元化合物、三元化合物等之分,其中三元半导体CuAlO2(或Cu2Al2O4)的制取,常采用CuO与Al2O3或Al(OH)3共热的方法。试分析并回答:
(l)试完成如下化学方程式:
_______CuO+_______ Al2O3![]() _______Cu2Al2O4+_______ ↑
_______Cu2Al2O4+_______ ↑
(2)上述反应能发生的理由主要是_____________。
(3)Al(OH)3有碱式和酸式两种电离方式,若25℃时,其酸式电离为Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13,则入Al(OH)3+OH-
AlO2-+H++H2O K=2.0×10-13,则入Al(OH)3+OH-![]() AlO2-+2H2O的平衡常数K’=_______(列式并计算)。该反应的△H_______(填“<”“>”或“=”)0。
AlO2-+2H2O的平衡常数K’=_______(列式并计算)。该反应的△H_______(填“<”“>”或“=”)0。
(4)经实验测定,“AlO2-” 的形式应该是[Al(OH)4]-,则AlCl3溶液与Na[Al(OH)4]溶液作用的离子方程式是_________________。
(5)用石墨电极电解Na[Al(OH)4] 溶液是制取高品质用Al(OH)3的方法之一。该电解反应的离子方程式是_________________。
【答案】4 2 2 1O2 CuO受热分解生成Cu2O和O2, Cu2O与Al2O3作用生成Cu2Al2O4(Cu+处于全充满稳定结构,固态时更稳定) K’=![]() < 3[Al(OH)4]-+Al3+=4Al(OH)3↓ 4[Al(OH)4]-+2H2O
< 3[Al(OH)4]-+Al3+=4Al(OH)3↓ 4[Al(OH)4]-+2H2O![]() 4Al(OH)3↓+4OH-+2H2↑+O2↑
4Al(OH)3↓+4OH-+2H2↑+O2↑
【解析】
(1)根据氧化还原反应的规律及元素守恒法配平化学方程式;
(2)反应会向生成稳定产物的方向发生;
(3)根据化学平衡常数的定义式变形推导得出结论;根据水解反应是吸热反应分析该反应的热效应;
(4)根据偏铝酸根离子与铝离子的双水解反应作答;
(5)根据电解原理的放电顺序结合电解质的酸碱性分析书写离子方程式。
(1)根据化学式CuAlO2可知Cu显+1价,Al显+3价,则反应CuO+_______ Al2O3![]() _______Cu2Al2O4+_______中,Cu元素化合价降低,根据氧化还原反应的规律可知,氧元素化合价应从-2价升高到0价,推出生成的气体为O2,电子转移数为4,故Cu2Al2O4的化学计量数为2,结合元素守恒可知该反应的化学方程式为:4CuO+2Al2O3
_______Cu2Al2O4+_______中,Cu元素化合价降低,根据氧化还原反应的规律可知,氧元素化合价应从-2价升高到0价,推出生成的气体为O2,电子转移数为4,故Cu2Al2O4的化学计量数为2,结合元素守恒可知该反应的化学方程式为:4CuO+2Al2O3![]() 2Cu2Al2O4+O2↑,故答案为:4;2;2;1O2;
2Cu2Al2O4+O2↑,故答案为:4;2;2;1O2;
(2)CuO受热分解生成Cu2O和O2, Cu2O与Al2O3作用生成Cu2Al2O4,分析分子内部结构可以看出Cu2Al2O4中的Cu+处于全充满稳定结构,固态时更稳定,因此该反应能发生,故答案为:CuO受热分解生成Cu2O和O2, Cu2O与Al2O3作用生成Cu2Al2O4(Cu+处于全充满稳定结构,固态时更稳定);
(3)K’=![]() ,该反应是AlO2-水解反应的逆反应,故该反应为放热反应,该反应的△H<0,故答案为:20;<;
,该反应是AlO2-水解反应的逆反应,故该反应为放热反应,该反应的△H<0,故答案为:20;<;
(4)[Al(OH)4]-= AlO2-+2H2O,故AlCl3溶液与Na[Al(OH)4]溶液会发生双水解反应生成氢氧化铝沉淀,该反应的离子方程式为:3[Al(OH)4]-+Al3+=4Al(OH)3↓;
(5)石墨电极电解Na[Al(OH)4] 溶液,根据溶液中的离子放电顺序可知,阳极水中氢氧根离子放电生成O2和H+,阴极水中的氢离子放电生成H2和OH-,则Al3+在阴极会结合OH-生成Al(OH)3沉淀,反应的总的离子方程式为:4[Al(OH)4]-+2H2O![]() 4Al(OH)3↓+4OH-+2H2↑+O2↑。
4Al(OH)3↓+4OH-+2H2↑+O2↑。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在一个恒容容器中充入N2(g)和H2(g),一定条件下发生反应N2(g)+3H2(g)![]() 2NH3(g),若温度保持不变,下列说法正确的是( )
2NH3(g),若温度保持不变,下列说法正确的是( )
A.容器中的压强始终保持不变
B.反应达到限度后N2(g)和H2(g)的物质的量之比一定为1:3
C.正、逆反应速率相等时各物质质量不再变化
D.当充入足够N2(g)后,H2(g)会全部转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中M、W、T、L为同一短周期元素,L核外最外层电子数是W核外电子数的一半。下列叙述正确的是
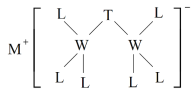
A.化合物ML属于离子化合物,也属于弱电解质
B.该新化合物中T满足8电子稳定结构
C.W的最高价氧化物可以与水反应生成弱酸
D.元素非金属性的顺序为W>T>L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型)。下列关于普伐他汀的性质描述正确的是( )
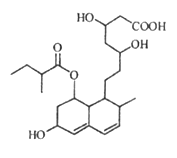
A. 1mol该物质最多可与2molNaOH反应
B. 能发生加成、取代、不能发生消去反应
C. 不能使溴水褪色
D. 能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
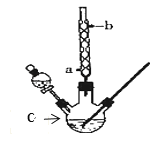
【题目】某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去)。已知下列数据:
乙醇 | 乙酸 | 乙酸乙酯 | 98%浓硫酸 | |
熔点/℃ | ﹣117.3 | 16.6 | ﹣83.6 | |
沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
请回答下列问题:
(1)仪器C的名称为______,球形冷凝管的作用是_____。
(2)向C中加入反应物,待充分反应后,将C中的混合物倒入装有饱和碳酸钠溶液的烧杯中充分振荡洗涤。饱和碳酸钠溶液作用是(填字母):_____
A.中和乙酸并溶解乙醇
B.碳酸钠溶液呈碱性,有利于乙酸乙酯的水解
C.加速乙酸乙酯的生成,提高其产率
D.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
(3)经多次振荡洗涤、静置分液后,为了进一步提纯乙酸乙酯,可采用蒸馏的方法,蒸馏时控制温度在__左右,温度计的水银球应位于____。
(4)若实验所用乙酸质量为2.4g,乙醇质量为2.1g,得到纯净的产品质量为2.64g,则乙酸乙酯的产率是______。
(5)乙酸乙酯与氢氧化钠溶液发生反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种无色无味的晶体,他在医药、炸药、照相药剂、树脂及农药合成等中应用广泛,它又是汽车安全气囊最理想的气体发生原料。有关他的制取以及纯度测定实验如下,试分析并回答:
(1)①方法一,液氨法,液氨与金属钠反应生成NaNH2,再与笑气反应(NaNH2+N2O→NaN3+NaOH+Y),Y的常用检测检验方法是_____________;
②方法二,水合肼法,N2H4H2O+NaOH+C2H5ONO= NaN3+C2H5O H+3H2O,C2H5ONO即亚硝酸乙酯,可用乙醇、硫酸与NaNO2来制取,其中C2H5ONO从组成看,可用另一种同分异构体代替:___________(写名称);由此有人提出用N2H4与NaNO2在一定条件下直接制取NaN3,其化学方程式是__________;
③方法三,尿素法,尿素[CO(NH2)2]与硝酸、浓硫酸、锌电解还原、NaNO2及脱水等经一系列反应后生成NH2CON3,后者再与NaOH反应,即发生NH2CON3+NaOH→NaN3+Y+Z+H2O,生成NaN3,则Z的俗名是_____。
(2)采用如下装置测定NaN3纯度:准确称量1.40克NaN3样品,与NaClO反应产生N2并放出热量(注:杂质不与NaClO反应)。
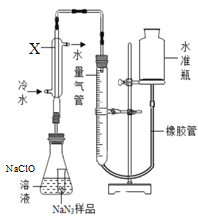
①使小试管中的NaN3样品与NaClO溶液接触的操作是____________;该反应的化学方程式是___________;
②仪器X的名称是____________,使用冷水冷凝的目的是冷却生成的气体及____;反应前应将液面调节到量气筒的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是__________;
③常温下量气筒读数为672mL(N2的密度为1.25 gL-1)。则该NaN3样品的纯度是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,中国科学家运用穿山甲的鳞片特征,制作出中弹后可自我恢复的防弹衣!这神奇的秘密就在于它的分子结构,它以一种独特方式连接在一起(图示如下),所以分子能保留对最初形状的记忆。这种记忆结构使得鳞片能够经受住外部的强力物理冲击,而且用水就能唤起这种记忆,同时在可变形的参与下进行自我修复,只要这种鳞片保持完整,无论变形有多严重,都可以完全恢复到初始状态。
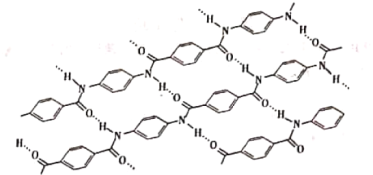
试分析并回答:
(1)该耐高温的高分子液晶树脂的单体是A(呈碱性)和_______(B),链内官能团主要是_________(均写名称)。
(2)C=OH-N中,除共价键外,还有______(写作用力名称)。
(3)苯与足量硝酸(混酸)作用往往得到间二硝基苯,混酸又要氧化-NH2,所以制取上述单体A有难度。据查其中的两种方法如下:
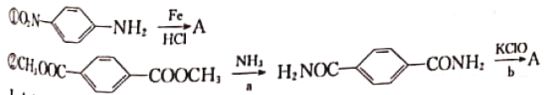
I.b的化学方程式是_________;
II.完成对硝基苯胺制取的路线:_________
![]() 。
。
(4)B的符合下列条件的同分异构体是________(写结构简式)。
①能发生银镜反应;②仍是苯环上的对位二取代物或仅一取代物;③分子中不含酚羟基、O-O键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置,使浆液分离成固体混合物和含铬元素溶液,并回收利用。用惰性电极电解时,下列说法正确的是:

A.a极产生氧气,b极产生氢气
B.a电极区溶液pH值减小
C.含铬微粒主要以Cr2O72-形式在b极区聚集
D.CrO42-能从浆液中分离出来向a极区迁移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com