

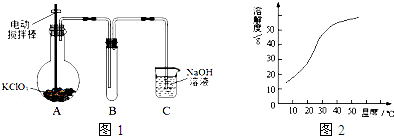
分析 (1)精制过程就是将杂质离子转化为沉淀除去的过程,Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀;
(2)添加钡试剂除去SO42-,注意不能引入新的杂质;
(3)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后;
(4)氯化钠电解生成氢氧化钠、氯气和氢气;
(5)阳极产物为氯气,依据氯气的性质回答即可.
解答 解:(1)Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀,离子反应分别为Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓,
故答案为:Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓;
(2)添加钡试剂除去SO42-,注意不能引入新的杂质,选Ba(NO3)2会引入杂质硝酸根离子,所以该钡试剂不能选用,故答案为:AC;
(3)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,所以加入试剂不合理的顺序为a,
故答案为:bc;
(4)电解食盐水得到氢氧化钠、氯气和氢气,俗称氯碱工业,电解方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH,故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH;
(5)氯气可以应用制取漂白粉、生产盐酸、应用于自来水消毒、制高纯硅、合成塑料等,故答案为:制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料.
点评 本题考查粗盐提纯及电解原理,明确发生的离子反应及电解反应是解答的关键,注意除杂不能引入新的杂质及试剂的添加顺序,题目难度中等.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3 | B. | Cl2 | C. | KClO3 | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +CH3COCHCOOC2H5$→_{10℃搅拌12h}^{浓H_{2}SO_{4}}$
+CH3COCHCOOC2H5$→_{10℃搅拌12h}^{浓H_{2}SO_{4}}$

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )
常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )| A. | ROH是一种强碱,MOH是一种弱碱 | B. | 在x点,c(M+)=c(R+) | ||
| C. | 稀释前,c(ROH)<10c(MOH) | D. | 稀释前,c(ROH)=10c(MOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com