
| A. | 取用钠、钾、白磷时,没用完的药品要放回原瓶 | |
| B. | 用pH试纸测得氯水的pH为2 | |
| C. | 氯水、硝酸银溶液存放在配有磨口塞的棕色细口瓶中 | |
| D. | 金属钠着火时,用细沙覆盖灭火 |
分析 A.金属钠或钾能与空气中的水或氧气反应;
B.氯水中次氯酸具有漂白性;
C.见光易分解的药品要放在棕色瓶中,与玻璃中二氧化硅不反应的药品可以用配有磨口塞的试剂瓶盛放,液体要放置在细口瓶中;
D.钠燃烧生成过氧化钠,钠和水反应生成氢气,过氧化钠和水、二氧化碳反应生成氧气,促进钠燃烧.
解答 解:A.金属钠或钾能与空气中的水或氧气反应,剩余的药品要放回原瓶,那么不存在安全隐患,故A正确;
B.氯水中次氯酸具有漂白性,所以不能用pH试纸测定氯水pH值,应该用pH计,故B错误;
C.见光易分解的药品要放在棕色瓶中,与玻璃中二氧化硅不反应的药品可以用配有磨口塞的试剂瓶盛放,液体要放置在细口瓶中,次氯酸和硝酸银见光易分解,且二者和二氧化硅不反应,所以氯水、硝酸银溶液存放在配有磨口塞的棕色细口瓶中,故C正确;
D.钠燃烧生成过氧化钠,钠和水反应生成氢气,过氧化钠和水、二氧化碳反应生成氧气,促进钠燃烧,所以不能用泡沫灭火器灭钠失火,应该用细沙覆盖灭火,故D正确;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及药品存放、物质性质、pH测定等知识点,明确物质性质及实验基本操作是解本题关键,易错选项是A.


科目:高中化学 来源: 题型:解答题

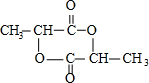 ;
; )在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n
)在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n +n
+n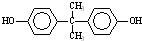 →
→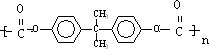 +4nCH3OH.
+4nCH3OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.
甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力发展太阳能和风力发电机可缓解电力紧张问题 | |
| B. | 将地沟油回收加工为燃料油,提高资源的利用率 | |
| C. | 推广使用一次性木筷,减少疾病传染 | |
| D. | 推广使用电动汽车、天然气汽车等环保公共交通工具 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入的物质 | 结论 | |
| A | 100mL 2mol•L-1H2SO4 | 反应结束后,c(Na+)=c(SO42-) |
| B | 0.20molCaO | 溶液中$\frac{c(O{H}^{-})}{c(HC{O}_{3}^{-})}$增大 |
| C | 200mL H2O | 由水电离出的c(H+)•c(OH-)不变 |
| D | 0.4molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
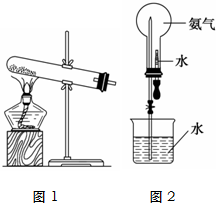 氨气是化学实验室常需制取的气体.实验室制取氨气的装置如图1所示:
氨气是化学实验室常需制取的气体.实验室制取氨气的装置如图1所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | 淀粉溶液遇碘变成蓝色,可用于检验碘单质的存在 | |
| C. | Fe在常温下遇浓硫酸发生钝化,可用铁制容器盛放冷的浓硫酸 | |
| D. | Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com