
【题目】Ⅰ.甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g);△H>0
CO2(g)+3H2(g);△H>0
(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为___。
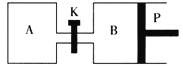
(2)如图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g)和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,维持其他条件不变,若打开K,一段时间后重新达到平衡,容器B的体积为___L(连通管中气体体积忽略不计,且不考虑温度的影响)。
Ⅱ.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)![]() CH3OH(g)
CH3OH(g)
下表所列数据是该反应在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.27 | 0.012 |
(1)300℃下,将2molCO、6molH2和4molCH3OH充入2L的密闭容器中,判断反应___(填“正向”或“逆向”)进行。
(2)要提高CO的转化率,可以采取的措施是___(填序号)。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
【答案】0.01mol·L-1·s-1 1.75a 正向 df
【解析】
Ⅰ. ⑴根据压强之比等于物质的量之比,得出20s时混合物的物质的量,再根据三段式建立关系,计算甲醇消耗得物质的量,再计算速率。
⑵先计算单独B容器达到平衡时的体积,再计算AB中容器所有物质反应后的物质的量的,再根据体积之比等于物质的量之比,得到反应后总的容器体积,再计算B容器的体积。
Ⅱ.⑴根据浓度商与平衡常数比较。
⑵根据温度升高,平衡常数减小,说明反应是放热反应,a.升温,平衡逆向移动,转化率降低;b.加入催化剂,平衡不移动,转化率不变;c.增加CO的浓度,平衡正向移动,但CO转化率降低;d.加入H2加压,平衡正向移动,CO转化率增大;e.加入惰性气体加压,平衡不移动,转化率不变;f.分离出甲醇,平衡正向移动,转化率增大。
Ⅰ.⑴一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则有![]() ,则n(20s)=4.8mol,
,则n(20s)=4.8mol,
1x + 3x + x+3x = 4.8,则x = 0.4,甲醇表示该反应的速率为![]() ;故答案为:0.01mol·L-1·s-1。
;故答案为:0.01mol·L-1·s-1。
⑵如图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g)和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,根据![]() ,则
,则![]() ,得到B中反应后物质的量n(B) =5.4mol,为维持其他条件不变,若打开K,一段时间后重新达到平衡,A、B的比例相同,可以理解为全部混合,n(总) = 1mol+2mol+1.2mol+2.4mol = 6.6mol,根据B中容器反应前后物质的量的比例关系得出3.6mol:5.4mol = 6.6mol :n(反应后总),n(反应后总)= 9.9mol,再根据
,得到B中反应后物质的量n(B) =5.4mol,为维持其他条件不变,若打开K,一段时间后重新达到平衡,A、B的比例相同,可以理解为全部混合,n(总) = 1mol+2mol+1.2mol+2.4mol = 6.6mol,根据B中容器反应前后物质的量的比例关系得出3.6mol:5.4mol = 6.6mol :n(反应后总),n(反应后总)= 9.9mol,再根据![]() ,得到
,得到![]() ,V = 2.75a L,原来A容器为aL,因此容器B的体积为2.75a La L = 1.75aL ;故答案为:1.75a。
,V = 2.75a L,原来A容器为aL,因此容器B的体积为2.75a La L = 1.75aL ;故答案为:1.75a。
Ⅱ.⑴300℃下,将2molCO、6molH2和4molCH3OH充入2L的密闭容器中, ,因此反应正向进行;故答案为:正向。
,因此反应正向进行;故答案为:正向。
⑵根据温度升高,平衡常数减小,说明反应是放热反应,
a.升温,平衡逆向移动,转化率降低,故a不符合题意;
b.加入催化剂,平衡不移动,转化率不变,故b不符合题意;
c.增加CO的浓度,平衡正向移动,但CO转化率降低,故c不符合题意;
d.加入H2加压,平衡正向移动,CO转化率增大,故d符合题意;
e.加入惰性气体加压,平衡不移动,转化率不变,故e不符合题意;
f.分离出甲醇,平衡正向移动,转化率增大,故f符合题意;
综上所述,答案为df。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】25C时,有关弱酸的电离平衡常数如下表:

下列有关微粒浓度的说法正确的是( )
A.pH均为8的NaCN溶液、Na2CO3溶液、CH3COONa溶液:c(Na2CO3)>c(NaCN)>c(CH3COONa)
B.浓度均为0.1mol/LNaHCO3和Na2CO3混合溶液中:2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3)
C.0.2mol/LHCN溶液与0.lmol/LNaOH溶液等体积混合所得溶液中:c(HCN)>c(Na+)>c(CN-)>c(OH-)
D.浓度均为0lmol/LCH3COOH和CH3COONa混合溶液中:c(CH3COOH)+c(H+)>c(CH3COO-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是
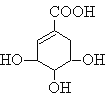
A.分子式为C7H6O5
B.分子中含有2种官能团
C.可发生加成和取代反应
D.在水溶液羧基和羟基均能电离出H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=0.1反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A.通入CO后,正反应速率逐渐增大
B.升高温度,H2S浓度增加,表明该反应是吸热反应
C.CO的平衡转化率为80%
D.反应前H2S物质的量为7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲、乙、丙三种不同物质(不含结晶水)的溶解度曲线图。下列有关叙述正确的是( )
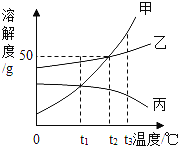
A.t1℃时,分别取出相同质量的甲、乙两种饱和溶液升温到t2℃时,甲和乙溶质的质量分数相等
B.将三种饱和溶液分别从t3℃降低到t2℃时,甲和乙溶质的质量分数减小,丙的溶质的质量分数不变
C.t2℃时,将甲、乙两种饱和溶液分别恒温蒸发等质量的水,析出晶体的质量可能不等
D.当甲的饱和溶液中含有少量乙时,可以采取冷却热饱和溶液的办法提取乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各离子方程式中,属于水解反应的是
A.HCO3-+H2O ![]() H3O++CO32-
H3O++CO32-
B.CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
C.PO43-+H3O+ ![]() HPO42-+H2O
HPO42-+H2O
D.H2O+H2O![]() H3O++OH-
H3O++OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是
①对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的产量一定增加
②常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等浓度的盐酸与NaOH溶液等体积混合后形成溶液b,水的电离程度a>b。
③常温下,AgCl在同物质的量浓度的氨水和NaCl溶液中的溶解度比较,前者大。
④若将适量CO2通入0.1 mol/LNa2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2c(CO32-)+ c(HCO3ˉ)= 0.1 mol/L
⑤常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka·Kh=Kw
A.①②④⑤B.②④⑤C.②⑤D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多硫化钠Na2Sx(x≥2)在结构上与Na2O2、FeS2等有相似之处。Na2Sx在碱性溶液中与NaClO反应可生成Na2SO4,下列说法错误的是
A.NaClO是氧化剂
B.Na2SO4是氧化产物
C.若反应中Na2Sx与NaClO的物质的量之比为1:13,则x为5
D.若x=3,则反应的离子方程式为:S32-+10ClO-+4OH-=3SO42-+10Cl-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洋蓟属高档蔬菜。从洋蓟提取的物质A具有良好的保健功能和药用价值,A在酸性条件下水解可生成B和C,反应可表示为( )

A.A在酸性条件下水解生成B和C属于取代反应
B.1molA和足量H2反应,最多消耗14molH2
C.B能和浓溴水发生加成反应,1molB最多加成4molBr2
D.1molC分子最多可以和5molNaOH溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com