
下列实验现象不能说明相关结论的是( )
A.将铜与浓硫酸共热,产生 使石蕊溶液变红的气体,说明浓硫酸具有酸性
使石蕊溶液变红的气体,说明浓硫酸具有酸性
B.将金属钠投入冷水中,钠熔为小球,说明钠与水的反应为放热反应且钠的熔点低
C.向AgCl浊液中滴加Na2S溶液,白色沉淀变成黑色,说明AgCl的溶解平衡正向移动
D.向Al(OH)3沉淀中滴加NaOH溶液或盐酸,沉淀均消失,说明Al(OH)3是两性氢氧化物
科目:高中化学 来源: 题型:

有一反应:2A+B2C,其中A、B、C均为气体,如图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,则下列描述正确的是( )
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下a点若要达到平衡,可以采取增大压强的方法
D.c点时v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定浓度的NaHCO3溶液中加入适量下列物质,一定能使HCO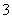 数目减少,CO
数目减少,CO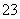 数目增加的是( )
数目增加的是( )
A.稀盐酸 B.Ba(OH)2溶液
C.NaOH溶液 D.Na2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.已知H2A在水中存在以下平衡:H2A===H++HA-,HA-H++A2-。
(1)常温下NaHA溶液的pH________(填选项字母),原因是________。
A.大于7 B.小于7
C.等于7 D.无法确定
(2)某温度下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1 KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是________。
A.c(H+)·c(OH-)= 1.0×10-14
1.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________(填选项字母)。
A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
Ⅱ.含有Cr2O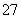 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O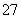 。为了使废
。为了使废 水的排放达标,进行如下处理:
水的排放达标,进行如下处理:
Cr2O
 Cr3+、Fe3+
Cr3+、Fe3+ Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
(1)该废水中加入绿矾和H+,发生反应的离子方程式为___________。
(2)若处理后的废水中残留的c(Fe3+)=2.0×10-13 mol·L-1,则残留的Cr3+的浓度为______________。(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)
3]=6.0×10-31)
查看答案和解析>>
科目:高中化学 来源: 题型:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第________周期,第________族;PbO2的酸性比CO2的酸性________(填“强”或“弱”)。
(2)Pb O2与浓盐酸共热生成黄绿色气体,反应的化学方程式为________________。
O2与浓盐酸共热生成黄绿色气体,反应的化学方程式为________________。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为______________;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解___,阴极上观察到的现象是________________;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为_______,这样做的主要缺点是________。
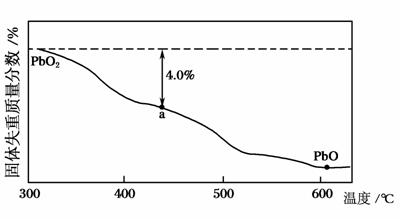
(4)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%(即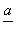 ×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和mn值________。
×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和mn值________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的叙述正确的是( )
A.将一定量的氯气通入30 mL浓度为10.0mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
B.实验室可以配制一种仅含Al3+、K+、SO42-、NO3-这4种离子(不考虑来源于水电离的离子)的溶液,且4种离子的浓度均为1mol/L
C.HCl、FeCl3、Fe3O4、NaOH都可通过置换反应一步得到也可通过化合反应一步得到
D.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2 + 3H2 = 2NH3
ΔH=—92.4 KJ/mol,则N≡N键的键能是( )
A.431 KJ/mol B.946 KJ/mol C.649 KJ/mol D.869 KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
①维生素C具有还原性,在人体内起抗氧化作用
②NO2溶于水时发生氧化还原反应 ③1 mol Cl2参加反应转移电子数一定为2NA ④阴离子都只有还原性
A.①② B.②③
C.③④ D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com