
【题目】硝基苯(![]() 可写成C6H5NO2)是一种剧毒化学品,具有致畸、致突变和致癌性。处理含有硝基苯废水的方法有很多,下图是铁、碳微电池法处理含硝基苯废水的工业流程图:
可写成C6H5NO2)是一种剧毒化学品,具有致畸、致突变和致癌性。处理含有硝基苯废水的方法有很多,下图是铁、碳微电池法处理含硝基苯废水的工业流程图:
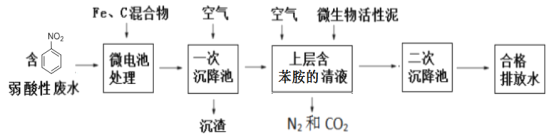
请回答下列问题:
(1)实验室制备硝基苯的化学方程式:_______________________________________;
(2)用分液漏斗分离硝基苯和水的混合物时,硝基苯从_______(填“上”或“下”)口流出。
(3)微电池处理过程中,原电池的负极反应为:Fe-2e-=Fe2+;
①碳表面硝基苯在电极上被还原成苯胺(![]() )的电极反应方程式为:_______________________;
)的电极反应方程式为:_______________________;
②微电池处理过程中部分硝基苯被新生成的活性Fe2+还原成苯胺,该反应的离子反应方程式为:__________________________________________________;
(4)①一次沉降池中通入空气的目的:_____________________________________;
②一次沉降池中适当的升温有利于沉渣的迅速沉降,分析原因:_______________________;(用适当的文字描述和离子方程式解释)
(5)上图中微生物在空气存在的条件下降解苯胺的化学反应方程式为:____________________________。
(6)利用惰性吸附电极电解含硝基苯的废水,同样可以将剧毒的硝基苯转化成苯胺,在电解的过程中,含硝基苯的废水应从_____________极室流入(填:“阳”或“阴”)。
【答案】![]() +HNO3
+HNO3![]()
![]() +H2O 下
+H2O 下 ![]() +6e-+6H+=
+6e-+6H+=![]() +2H2O
+2H2O ![]() +6Fe2++6H+=
+6Fe2++6H+=![]() +6Fe3++2H2O 将Fe2+充分氧化成Fe3+ Fe3+存在水解平衡:Fe3++3H2O
+6Fe3++2H2O 将Fe2+充分氧化成Fe3+ Fe3+存在水解平衡:Fe3++3H2O![]() Fe(OH)3+3H+,升温使水解平衡正向移动,产生更多的Fe(OH)3吸附沉渣 4
Fe(OH)3+3H+,升温使水解平衡正向移动,产生更多的Fe(OH)3吸附沉渣 4![]() +31O2=24CO2+14H2O+2N2 阴
+31O2=24CO2+14H2O+2N2 阴
【解析】
含硝基苯的酸性废水和Fe、C混合发生原电池反应,负极为Fe失电子生成Fe2+,正极为硝基苯得电子还原成苯胺,通过一次沉降将Fe3+、未反应的Fe、C等固体物质除去,上层苯胺在微生物活性泥作用下被空气氧化成二氧化碳和氮气,通过二次沉降将微生物活性泥等固体沉降,此时排放的水已达排放标准。
(1)实验室用苯和浓硫酸、浓硝酸加热到55℃~60℃制备硝基苯,方程式为:![]() +HNO3
+HNO3![]()
![]() +H2O;
+H2O;
(2)硝基苯与水互不相溶,硝基苯的密度比水大,在下层,故硝基苯从分液漏斗下口流出;
(3)①硝基苯在正极得电子,发生还原反应,生成![]() ,硝基苯(
,硝基苯(![]() 可写成C6H5NO2),
可写成C6H5NO2),![]() 转化为
转化为![]() ,脱去2个O,加入2个H,脱去1个O原子,化合价降低2价,加入1个H化合价降低1价,则共降低6价,电极反应为:
,脱去2个O,加入2个H,脱去1个O原子,化合价降低2价,加入1个H化合价降低1价,则共降低6价,电极反应为:![]() +6e-+6H+=
+6e-+6H+=![]() +2H2O;
+2H2O;
②结合①中N元素化合价可写出硝基苯被Fe2+还原成苯胺的离子方程式为:![]() +6Fe2++6H+=
+6Fe2++6H+=![]() +6Fe3++2H2O;
+6Fe3++2H2O;
(4)①通入空气是将溶液中的Fe2+氧化成Fe3+,最后升高温度促进Fe3+水解,使其转化成Fe(OH)3沉淀而除去;
②结合①分析可知,Fe3+存在水解平衡:Fe3++3H2O![]() Fe(OH)3+3H+,升温使水解平衡正向移动,产生更多的Fe(OH)3吸附沉渣,故升温有利于沉渣的迅速沉降;
Fe(OH)3+3H+,升温使水解平衡正向移动,产生更多的Fe(OH)3吸附沉渣,故升温有利于沉渣的迅速沉降;
(5)在微生物存在下,苯胺被氧气氧化成二氧化碳和氮气,结合原子守恒、电子得失守恒可写出方程式为:4![]() +31O2=24CO2+14H2O+2N2;
+31O2=24CO2+14H2O+2N2;
(6)硝基苯得电子转化成苯胺,阴极得电子,应将硝基苯的废水应从阴极室流入。


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】科学家最近在-100 ℃的低温下合成了一种烃X,红外光谱和核磁共振氢谱表明其分子中的氢原子所处的化学环境没有区别,根据分析,绘制了该分子的球棍模型如图所示。下列说法中不正确的是( )
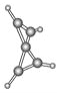
A. 该分子的分子式为C5H4
B. 该分子中碳原子的化学环境有2种
C. 该分子中的氢原子分布在两个相互垂直的平面上
D. 该分子中只有C—C键,没有![]() 键
键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品防腐剂R的结构简式如图所示:
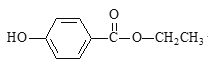
下列说法正确的是
A. R在酸性条件下水解生成乙酸和另一种有机物
B. 1个R分子最多有20个原子共平面
C. 苯环上含2个能与钠反应的官能团和1个乙基的R的同分异构体有10种
D. 1 mol R与3 mol H2反应生成的有机物分子式为C9H18O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol—OH(羟基)与l mol![]() 中所含电子数均为10NA
中所含电子数均为10NA
B.常温常压下,水蒸气通过过量的Na2O2使其增重2 g时,反应中转移的电子数为NA
C.0.lmol苯与足量氢气反应后,破坏碳碳双键的数目为0.3NA
D.10g KHCO3和CaCO3的固体混合物中含有的![]() 数目为0.1NA
数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验可以达到目的或得出结论的是( )
选项 | 实验目的或结论 | 实验过程 |
A | 探究浓硫酸的脱水性 | 向表面皿中加入少量胆矾,再加入约3mL浓硫酸,搅拌,观察实验现象 |
B | 相同温度下,Ksp(ZnS)<Ksp(CuS) | 向2mL ZnSO4 和CuSO4的混合溶液中逐滴加入0.01mol/L Na2S溶液,先出现白色沉淀 |
C | 淀粉已经完全水解 | 取少量酸催化后的淀粉水解液于试管中,先加入过量氢氧化钠溶液中和酸,再加少量碘水,溶液未变蓝 |
D |
| 向NaAlO2的试管中滴加碳酸氢钠溶液,产生白色沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知最简单的有机物E和直线型分子G在光照条件下反应,生成四面体型分子L和直线型分子M(组成G分子的元素为第三周期的元素),如下图。则下列判断错误的是
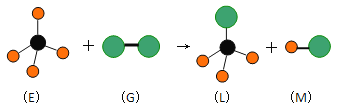
A. 常温常压下,E是一种无色无味的气体
B. 上述反应类型是加成反应
C. 在光照条件L能与 G继续发生与上述类似的反应
D. 上述反应类型是取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取乙酸乙酯的装置。请回答:
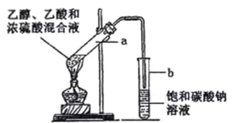
(1) 写出乙酸、乙醇酯化反应方程式__________
(2) 浓硫酸的作用是__________
(3) 下列有关该实验的说法中,正确的是__________
A.向 a 试管中加入沸石,其作用是防止加热时液体暴沸
B.饱和碳酸钠溶液可以除去产物中混有的乙酸
C.乙酸乙酯是一种无色透明、密度比水大的油状液体
D.若原料为 CH3COOH 和 CH3CH218OH,则乙酸乙酯中不含18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年,全球发生了禽流感。我国科学家发现金丝桃素对高致病性禽流感病毒杀灭效果良好,某种金丝桃素的结构式如下图,下列有关金丝桃素说法错误的是
![]()
A. 分子式为C17H23NO3
B. 苯环上的一氯取代物有3种
C. 可以发生取代、加成、酯化等反应
D. 1mol金丝桃素最多能和4molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟胺的电离方程式为: NH2OH+H2O ![]() NH3OH++OH-( 25℃时, Kb=9.0×l0-9)。用 0.l mol·L-1 盐酸滴定 20 mL 0.l mol·L-1 羟胺溶液,恒定 25℃时,滴定过程中由水电离出来的 H+浓度的负对数与盐酸体积的关系如图所示(己知: lg3=0.5)。下列说法正确的是
NH3OH++OH-( 25℃时, Kb=9.0×l0-9)。用 0.l mol·L-1 盐酸滴定 20 mL 0.l mol·L-1 羟胺溶液,恒定 25℃时,滴定过程中由水电离出来的 H+浓度的负对数与盐酸体积的关系如图所示(己知: lg3=0.5)。下列说法正确的是
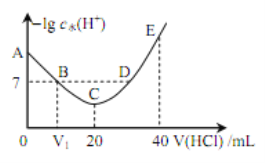
A. 图中 V1>10
B. A 点对应溶液的 pH=9.5
C. B、 D 两点对应的溶液均为中性
D. E 点对应溶液中存在:c(H+)=c (OH-)+c (NH3OH+)+c (NH2OH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com