
【题目】工业上制取冰晶石(![]() )的化学方程式为
)的化学方程式为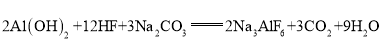 ,反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是( )
,反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是( )
A.简单氢化物的稳定性强弱
B.最高价氧化物对应水化物的碱性或酸性强弱
C.原子达到稳定结构失去或得到电子的多少
D.元素的最高化合价的高低
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径和主要化合价如表所示,下列说法正确的是( )
元素代号 | 原子半径/nm | 主要化合价 |
X | 0.160 | +2 |
Y | 0.143 | +3 |
Z | 0.102 | +6、﹣2 |
L | 0.099 | +7、﹣1 |
M | 0.077 | +4、﹣4 |
Q | 0.074 | ﹣2 |
A.等物质的量的X、Y的单质与足量的盐酸反应,生成![]() 的物质的量相等
的物质的量相等
B.Y与Q形成的化合物不能跟氢氧化钠溶液反应
C.在化学反应中,M原子与其他原子易形成共价键而不易形成离子键
D.Z的简单氢化物的稳定性强于L的简单氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用图甲装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用__(填序号)。
a.碱石灰 b.浓硫酸 c.五氧化二磷 d.氯化钙
(2)若探究氨气的溶解性,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是__。不能在K2的导管末端连接图乙中的__装置(填序号)。
(3)若探究氨气的还原性,需关闭K1、K3,K2连接纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气,生成的气体必须依次通过盛有__试剂和__试剂的洗气瓶。
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为__。
③尾气可用C装置处理,若尾气中含有少量Cl2,则C装置中应盛放__溶液(填化学式),反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用化合物A模拟工业上制备含氧酸D的过程如图所示,已知D为强酸,请回答下列问题。
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了_____而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A的化学式是_________;C的化学式是_______。
②D的浓溶液在常温下可与铜反应并生成C气体,反应的化学方程式是____,该反应______(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含有MgO、SiO2 等杂质]为原料,制备金属钛和铁红的工艺流程如下:已知:①酸溶时,FeTiO3转化为Fe2+和TiO2+;②本实验温度下,Ksp[Mg(OH)2]= 1.0×10-11;请回答下列问题:
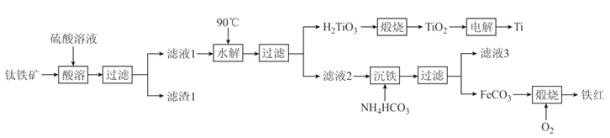
(1)FeTiO3中Ti元素的化合价为_______价。铁红的用途为________________(任写一种)。
(2)“水解”中,发生反应的离子方程式为____________________________________________。
(3)“沉铁”中,气态产物的电子式为_________;该过程需控制反应温度低于35℃,原因为_____________。
(4)FeCO3转化为铁红时,发生反应的化学方程式为________________________________________。
(5)滤液3可用于制备Mg(OH)2。若滤液3 中c(Mg2+)=1.2×10-4 mol·L-1,向其中加入等浓度等体积的NaOH溶液时,通过计算说明有无沉淀生成______________________________(溶液体积近似叠加)。
(6)电解生产钛时用TiO2和石墨做电极,电解质为熔融的CaO,则阴极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G是七种常见的短周期元素,其原子序数依次增大,请根据所给信息填写表中空白,并回答下列问题:
编号 | 基本信息 | 解决的问题 |
① | 其中两种元素的原子核外电子层数与最外层电子数之比分别为 | 这两种元素分别是______(填元素符号,下同)、______. |
② | 其中一种元素的氧化物与强酸、强碱均能反应;另一种元素的单质、氧化物及氧化物对应的水化物均能与NaOH溶液反应 | 这两种元素分別是______、______. |
③ | G能与A、E分别形成原子个数比均为 | X的分子式为______, |
(1)仅由表中信息还不能确定的元素是______(填字母序号),若要确定其是何种元素,还需要的条件是______(填序号).
a.单质能与氧气反应
b.最高价氧化物对应的水化物是强酸
e.单质在常温下为固体
d.简单氯化物的稳定性比![]() 的简单氯化物强
的简单氯化物强
(2)基本信息②中,两种元素的氧化物分别与NaOH溶液反应的离子方程式为__________________,__________________.
(3)上述某两种元素间可形成原子个数比为![]() 及
及![]() 的两种能与水反应的常见化合物,写出前者与H2O反应的离子方程式:__________________.
的两种能与水反应的常见化合物,写出前者与H2O反应的离子方程式:__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香天竺葵醇具有温和、香甜的玫瑰花气息,其结构式如图所示。下列有关香天竺葵醇的说法错误的是
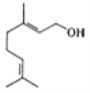
A.分子中含有两种官能团
B.该物质中的碳原子一定全部共面
C.使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理不同
D.香天竺葵醇能发生加聚反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 三种元素的原子具有相同的电子层数,
三种元素的原子具有相同的电子层数,![]() 原子的核电荷数比
原子的核电荷数比![]() 原子的核电荷数大2,
原子的核电荷数大2,![]() 原子的电子总数比
原子的电子总数比![]() 原子的电子总数大4;
原子的电子总数大4;![]() 单质
单质![]() 与足量
与足量![]() 溶液反应可生成
溶液反应可生成![]() (标准状况下)氢气,此时
(标准状况下)氢气,此时![]() 转化为与氖原子具有相同电子层结构的离子。
转化为与氖原子具有相同电子层结构的离子。
(1)写出各元素的名称:![]() ______,
______,![]() ______,
______,![]() ______。
______。
(2)写出![]() 的最高价氧化物对应的水化物与
的最高价氧化物对应的水化物与![]() 的简单氢化物的水溶液反应的离子方程式:____________。
的简单氢化物的水溶液反应的离子方程式:____________。
(3)![]() 形成的简单离子的氧化性比
形成的简单离子的氧化性比![]() 形成的简单离子的氧化性______ (填“强”或“弱”),其原因是______。
形成的简单离子的氧化性______ (填“强”或“弱”),其原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物用C6H10O5表示。下列有关说法正确的是
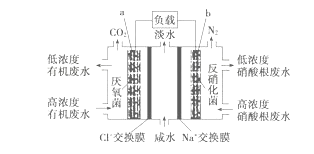
A. b电极为该电池的负极
B. b电极附近溶液的pH减小
C. a电极反应式:C6H10O5-24e-+7H2O===6CO2↑+24H+
D. 中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com