
| A、有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 |
| B、金属钠着火燃烧时,用泡沫灭火器灭火 |
| C、酒精灯打翻着火,用水灭火 |
| D、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
 X、Y、Z是三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,如图中的A、B、C分别表示三种单质两两反应的生成物:已知一个B分子中含有的Z元素的原子个数比C分子中的少一个.请回答下列问题:
X、Y、Z是三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,如图中的A、B、C分别表示三种单质两两反应的生成物:已知一个B分子中含有的Z元素的原子个数比C分子中的少一个.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、自然界硅元素的贮量丰富 |
| B、硅可用于制造光导纤维 |
| C、高纯度的单质硅被广泛用于制作计算机芯片 |
| D、硅可由二氧化硅还原制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 |
| B、金属钠着火燃烧时,用泡沫灭火器灭火 |
| C、用碳单质还原氧化镁制取金属镁 |
| D、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 乙醛在空气中易被氧化,沸点为20.8℃.40%的乙醛溶液久置会分层,其上层为无色油状液体.经测定无色油状液体为乙醛的自身加成物(C2H4O)n,其沸点比水的沸点高,分子中无醛基.现根据反应原理:(C2H4O)n
乙醛在空气中易被氧化,沸点为20.8℃.40%的乙醛溶液久置会分层,其上层为无色油状液体.经测定无色油状液体为乙醛的自身加成物(C2H4O)n,其沸点比水的沸点高,分子中无醛基.现根据反应原理:(C2H4O)n| H+(△) |
查看答案和解析>>
科目:高中化学 来源: 题型:
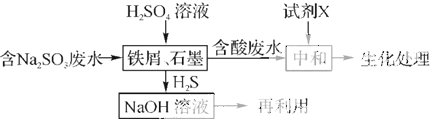
查看答案和解析>>
科目:高中化学 来源: 题型:
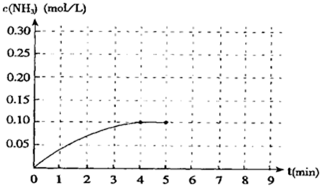
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com