
根据下列反应,可以判断有关物质的氧化性由强到弱的顺序正确的是( )。
①Cl2+2KI===2KCl+I2 ②2FeCl2+Cl2===2FeCl3 ③2FeCl3+2HI===2FeCl2+2HCl+I2 ④H2S+I2===S↓+2HI
A.H2S>I2>Fe3+>Cl2 B.Cl2>Fe3+>I2>S
C.Fe3+>Cl2>H2S>I2 D.Cl2>I2>Fe3+>H2S
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
NA代表阿伏加德罗常数。下列叙述正确的是 ( )。
A.标准状况下,22.4 L己烷中C—C共价键数目为5NA
B.0.1 mol·L-1 AlCl3溶液中含有氯离子数为0.3NA
C.1 mol Fe在1 mol Cl2中充分燃烧,转移电子数为3NA
D.20 g重水(12H2O)所含的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
我国某大型电解铜生产企业,其冶炼工艺中铜、硫回收率达到97%、87%。下图表示其冶炼加工的流程:

冶炼中的主要反应:Cu2S+O2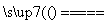 2Cu+SO2
2Cu+SO2
(1)烟气中的主要废气是________,从提高资源利用率和减排考虑,其综合利用方式是_________________________________________________________。
(2)电解法精炼铜时,阳极是________(填“纯铜板”或“粗铜板”);粗铜中含有的金、银以单质的形式沉淀在电解槽________(填“阳极”或“阴极”)的槽底,阴极的电极反应式是_______________________________________。
(3)在精炼铜的过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。
几种物质的溶度积常数(Ksp)
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| Ksp | 8.0×10-16 mol3·L-3 | 4.0×10-38 mol4·L-4 | 3.0×10-17 mol3·L-3 | 2.2×10-20 mol3·L-3 |
①调节电解液的pH是除去杂质离子的常用方法。根据上表中溶度积数据判断,含有等物质的量浓度的Fe2+、Zn2+、Fe3+、Cu2+的溶液,随pH升高最先沉淀下来的离子是________。
②一种方案是先加入过量的H2O2,再调节pH到4左右,加入H2O2的目的是_________________________________________________________________。
加入H2O2后发生反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是 ( )。
A.1.0 mol·L-1的KNO3溶液中:H+、Fe2+、Cl-、SO42-
B.c(H+)<c(OH-)的溶液中:Na+、K+、SO42-、ClO-
C.能使pH试纸变红的溶液中:K+、Ba2+、AlO2-、Cl-
D.pH=0的溶液中:Mg2+、Na+、F-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
离子反应是中学化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有________(填序号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。
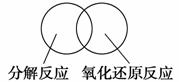
 |
(3)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。
| ①所有的离子方程式均可以表示一类反应 | |
| ②酸碱中和反应均可表示为H++OH-===H2O | |
| ③离子方程式中凡是难溶性酸、碱、盐均要标“↓”符号 |
(4)试列举出三种不同类别的物质(酸、碱、盐)之间的反应,它们对应的离子方程式都可用“Ba2++SO42-===BaSO4↓”来表示,请写出有关反 应的化学方程式(3个):
应的化学方程式(3个):
①_________________________________________ _____________________;
_____________________;
②______________________________________________________________;
③_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:(1)Tl3++2Ag===Tl++2Ag+,(2)Ag++Fe2+===Ag+Fe3+,(3)Fe+
2Fe3+===3Fe2+,下列离子氧化性比较顺序正确的是 ( )。
A.Tl3+>Fe3+>Ag+ B.Fe3+>Ag+>Tl3+
C.Tl+>Ag+>Fe2+ D.Tl3+>Ag+>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
最近科学家发现了氧元素的一种新的粒子O4,对于这种新粒子,下列说法不正确的
是( )
A.它是氧气的一种同素异形体 B.它是氧元素的一种同位素
C.它的摩尔质量是64 g·mol-1 D.它具有很强的氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
按下图的装置进行试验,若图中X轴表示阴极的电子的量,则Y轴可能表示为( )
|
|

|


 A. Cu2+物质的量浓度 B.C棒的质量
A. Cu2+物质的量浓度 B.C棒的质量 C.Fe棒的质量 D.Cl-物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化亚铜(CuH)是一种不稳定的物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50 ℃时反应可生成CuH。下列叙述中错误的是 ( )。
A.“某物质”具有还原性
B .CuH与盐酸反应可能产生H2
.CuH与盐酸反应可能产生H2
C.CuH与足量稀硝酸反应:CuH+3H++NO3-===Cu2++NO↑+2H2O
D.CuH在氯气中燃烧:CuH+Cl2===CuCl+HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com