
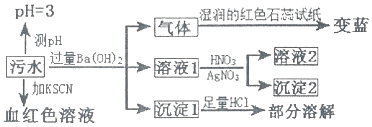
| A. | 该污水中一定存在Fe3+,不存在Fe2+ | |
| B. | 沉淀l为BaCO3和BaSO4 | |
| C. | 沉淀2可能为AgCl和Ag2SO4 | |
| D. | 该污水中一定存在NH4+、Cl-、Fe3+、SO42-离子 |
分析 污水pH=3,则不可能存在HCO3-,加入KSN呈血红色,则说明含有Fe3+,加入过量氢氧化钡生成沉淀1,且沉淀部分溶解,说明含有SO42-,沉淀1中含有氢氧化铁、硫酸钡等,气体能使湿润的红色石蕊试纸变蓝,则说明生成氨气,应含有NH4+,溶液1加入硝酸酸化的硝酸银生成沉淀,应生成AgCl,则含有Cl-,以此解答该题.
解答 解:A.由以上分析可知一定含有Fe3+,不能确定是否含有Fe2+,故A错误;
B.沉淀1中含有氢氧化铁、硫酸钡等,没有BaCO3,故B错误;
C.加入过量氢氧化钡,溶液1中不含硫酸根离子,沉淀2为AgCl,故C错误;
D.由以上分析可知该污水中一定存在NH4+、Cl-、Fe3+、SO42-离子,故D正确.
故选D.
点评 本题考查了离子的推断、检验,熟悉物质的性质是解本题关键,根据实验过程中反应现象、离子共存条件来确定溶液中存在的离子,同时考查学生综合运用知识解决问题的能力,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 久置的植物油发出难闻的气味是因为发生了氧化反应 | |
| B. | 《本草钢木》记载民间酿酒的工艺:“凡酸坏之酒,皆可蒸烧…”,这里用到的分离坏酒的方法在原理上是化学变化 | |
| C. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| D. | 在牙膏中添加Na2PO3F、NaF或SrF2等均能防治龋齿,当提供的F-浓度相同时,它们的作用是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
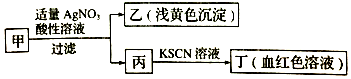
| A. | 如果甲中含有S2-,则乙是硫黄沉淀 | |
| B. | 丙中肯定含有Fe3+,所以甲是FeBr2溶液 | |
| C. | 甲中含有铁元素,可能显+2价或者+3价 | |
| D. | 若甲溶液滴加酸性KMnO4溶液,溶液变为黄色,则甲中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe$→_{高温}^{H_{2}O(g)}$Fe2O3$→_{高温}^{Al}$Al2O3 | |
| B. | Cu$→_{点燃}^{Cl_{2}}$CuCl2$\stackrel{FeCl_{3}(aq)}{→}$FeCl2 | |
| C. | FeS2$→_{高温}^{O_{2}}$SO2$\stackrel{H_{2}O_{2}(aq)}{→}$H2SO4 | |
| D. | NH3$→_{催化剂,△}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发展风能、太阳能发电 | B. | 推广煤液化、气化技术 | ||
| C. | 提倡聚碳酸酯可降解塑料的使用 | D. | 普及汞锌锰干电池的使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y 与氢元素所形成的化合物分子只含有极性键 | |
| B. | W2Y、W2Y2 中阴、阳离子个数比均为 1:2 | |
| C. | Z 的最高价氧化物对应水化物的酸性比 R 的强 | |
| D. | 将XY2通入 W 单质与水反应后的溶液中,生成的盐只有一种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com