
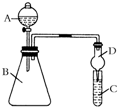
 某同学为验证元素周期表中元素性质的递变规律,利用如图装置可验证同主族非金属性的变化规律.设计了如下系列实验.
某同学为验证元素周期表中元素性质的递变规律,利用如图装置可验证同主族非金属性的变化规律.设计了如下系列实验.分析 (1)氯气氧化性强于硫单质,所以氯气能够与硫离子反应生成硫,自身被还原为氯离子;
(2)仪器A的名称为分液漏斗;
(3)氯气具有强氧化性,能将碘离子氧化为碘单质,碘遇淀粉试液变蓝色;氯气有毒,不能直接排空,可以用NaOH溶液稀释;
(4)盐酸酸性强于碳酸,二氧化碳能使石灰水变浑浊;盐酸挥发,应排除实验中干扰.
解答 解:(1)氯气氧化性强于硫单质,所以氯气能够与硫离子反应生成硫,反应的离子方程式为:S2-+Cl2═S↓+2Cl-,故答案为:S2-+Cl2═S↓+2Cl-;
(2)仪器A的名称为分液漏斗,故答案为:分液漏斗;
(3)KMnO4与浓盐酸反应生成氯气,氯气与淀粉碘化钾混合溶液反应生成碘单质,反应离子方程式为:
2I-+Cl2═I2+2Cl-,碘遇淀粉试液变蓝色,故C中溶液变为蓝色;过量的氯气会逸散到空气中,污染环境,可用NaOH溶液吸收,反应离子方程式为:2OH-+Cl2═Cl-+ClO-+H2O,故答案为:变蓝;NaOH;
(4)因碳酸比硅酸强,二氧化碳可与硅酸钠反应生成硅酸沉淀,溶液变浑浊,氯化氢具有挥发性,干扰实验结果,需要将二氧化碳中的氯化氢除掉,根据氯化氢与碳酸氢钠反应,而二氧化碳不反应,可以在B和C之间增加装有饱和NaHCO3溶液的洗气瓶,
故答案为:有白色沉淀生成;饱和NaHCO3.
点评 本题考查了探究金属单质的金属性强弱、非金属单质的非金属性强弱方法,题目难度中等,正确掌握判断金属性、非金属性强弱的方法,明确除杂试剂的作用原则:除去装置,不能引进新的杂质.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.9 | 6.5 | 4.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①图象中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压 | |
| B. | ②图象中纵坐标可以为镓的转化率 | |
| C. | ③图象中纵坐标可以为化学反应速率 | |
| D. | ④图象中纵坐标可以为体系内混合气体平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质生成的分解反应一定是氧化还原反应 | |
| B. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| C. | 氧化剂被氧化,还原剂被还原 | |
| D. | 没有氧元素参加的反应一定不是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属氟化物的晶格能顺序是LiF>NaF>KF>RbF>CsF;则钠的卤化物的晶格能顺序是NaF>NaCl>NaBr>NaI | |
| B. | ⅣA族元素氢化物沸点顺序是GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序是AsH3>PH3>NH3 | |
| C. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子 | |
| D. | 若盐酸的浓度是醋酸浓度的2倍;则盐酸中H+浓度也是醋酸中H+浓度的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
| 沉淀完全时的pH | 11.1 | 6.7 | 9.6 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 重金属盐能使蛋白质变性,所以误食重金属盐会中毒 | |
| B. | 蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,再加水也不溶解 | |
| C. | 浓HNO3溅在皮肤上,使皮肤呈黄色,是由于浓HNO3和蛋白质发生颜色反应 | |
| D. | 人工合成的具有生命活性的蛋白质-结晶牛胰岛素,是1965年我国科学家最先合成的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com