
| A. | 利用外接直流电源保护铁质建筑物,属于电化学中牺牲阳极的阴极保护法 | |
| B. | 碰撞理论和过渡态理论是常用的反应速率理论,其中过渡态理论可解释温度、催化剂等对反应速率的影响 | |
| C. | 人们通常用标准燃烧热或热值来衡量燃料燃烧放出热量的大小,其中标准燃烧热是指101kPa下,1g物质完全燃烧的反应热 | |
| D. | 改变影响化学平衡的一个因素,平衡将向着能够减弱这种改变的方向移动 |
分析 A.外接直流电源保护铁质建筑物利用的是电解池原理;
B.过渡状态理论认为:反应物分子并不只是通过简单碰撞直接形成产物,而是必须经过一个形成活化络合物的过渡状态,并且达到这个过渡状态需要的一定的活化能;
C.标准燃烧热是指101kPa下,1mol物质完全燃烧的反应热;
D.根据平衡移动原理分析.
解答 解:A.外接直流电源保护铁质建筑物利用的是电解池原理,牺牲阳极的阴极保护法属于原电池工作原理,故A错误;
B.过渡状态理论认为:反应物分子并不只是通过简单碰撞直接形成产物,而是必须经过一个形成活化络合物的过渡状态,并且达到这个过渡状态需要的一定的活化能,则过渡态理论不可解释温度对反应速率的影响,故B错误;
C.标准燃烧热是指101kPa下,1mol物质完全燃烧的反应热,某物质的热值高,其标准燃烧热不一定大,故C错误;
D.化学平衡移动原理:改变影响化学平衡的一个因素,平衡将向着能够减弱这种改变的方向移动,故D正确.
故选D.
点评 本题考查了原电池原理和电解池原理、反应原理、化学平衡移动原理等,题目难度中等,侧重于考查基本理论的考查.


科目:高中化学 来源: 题型:选择题
| X | |
| Y | Z |
| A. | 原子半径Z>Y>X | |
| B. | 氢化物的稳定性X>Y、Z>Y.可能X>Z | |
| C. | 最高价氧化物对应的水化物酸性Z>Y>X | |
| D. | 三种元素形成的简单离子半径X<Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 3 | C. | 2 | D. | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原X、Y混合气体积为1.2VL | B. | 原X、Y混合气体积为1.1VL | ||
| C. | 达平衡时,消耗X体积为0.25VL | D. | 达平衡时,消耗Y体积为0.05VL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
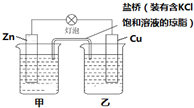
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数减小 | B. | BaO量不变 | C. | 氧气浓度不变 | D. | 平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com