
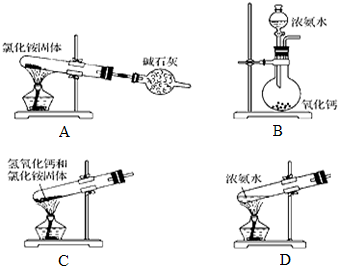
| ѡ�� | ʵ����� | ʵ��Ŀ�� |
| A | �������Һ�м�������ʯ��ʯ���� | ��֤������̼�������ǿ�� |
| B | �ڵ�����Һ�м���20%��ϡH2SO4ˮ�����������������Һ��������Ӧʵ�� | ��֤����ˮ���Ƿ������������� |
| C | ��CuSO4��Һ�м������NaOH��Һ����������ijͬѧ��Һ������ | ��֤��ͬѧ�Ƿ������� |
| D | ���Ҵ���Һ�в���һ�����ȱ�ڵ�ͭ˿ | ��֤�Ҵ��Ƿ�������ȩ |
| A�� | A | B�� | B | C�� | C | D�� | D |
���� A������ǿ����ȡ����ķ�Ӧ��
B������ˮ�����Һ�����ԣ�������ˮ�����������Ӧ�ڼ�����Һ�У�
C��CuSO4��Һ�м������NaOH��Һ���õ����������µ�������ͭ����Һ��
D�����ȱ�ڵ�ͭ˿����ΪCuO���������Ҵ���
��� �⣺A���������Һ�м�������ʯ��ʯ���巢��ǿ����ȡ����ķ�Ӧ������֤������̼�������ǿ������A��ȷ��
B������ˮ�����Һ�����ԣ�������ˮ�����������Ӧ�ڼ�����Һ�У���ˮ����ȼӼ������ԣ��ټ���������Һ��������Ӧʵ�飬��B����
C��CuSO4��Һ�м������NaOH��Һ���õ����������µ�������ͭ����Һ�������֤�Ƿ���������C��ȷ��
D�����ȱ�ڵ�ͭ˿����ΪCuO���������Ҵ������ɫ��Ϊ��ɫ����֤�Ҵ��ܱ���������D��ȷ��
��ѡB��
���� ���⿼�黯ѧʵ�鷽�������ۣ�Ϊ��Ƶ���㣬�������ʵ����ʼ���Ӧԭ��Ϊ���Ĺؼ����������ԱȽϡ�ˮ��ʵ�鼰������顢�л������ʵȼ�ʵ�������Ŀ��飬ע��ʵ��������Է�������Ŀ�ѶȲ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��M�Ļ�ѧʽΪFeS��F�ĵ���ʽΪ
��M�Ļ�ѧʽΪFeS��F�ĵ���ʽΪ ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ӧ���ȣ�L������ | B�� | ����Ӧ���ȣ�L�ǹ��� | ||
| C�� | ����Ӧ���ȣ�L������ | D�� | ����Ӧ���ȣ�L�ǹ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������ͭ��Cu2O����Ϊһ����Ҫ��������ԭ�ϣ���Ϳ�ϡ���ɫ�����ʹ������������Ź㷺����;���ش��������⣺
������ͭ��Cu2O����Ϊһ����Ҫ��������ԭ�ϣ���Ϳ�ϡ���ɫ�����ʹ������������Ź㷺����;���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C2H4��C2H2 | B�� | CH4��C2H6 | C�� | CH4��C2H4 | D�� | C2H2��C3H6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 10 mL 0.1 mol/L��ˮ��10 mL 0.1 mol/L�����ϣ�c��Cl-����c�� NH4+����c��OH-����c��H+�� | |
| B�� | 10 mL 0.1 mol/L NH4Cl��Һ��5 mL 0.2 mol/L NaOH��Һ��ϣ�c��Na+��=c��Cl-����c��OH-����c��H+�� | |
| C�� | 10 mL 0.1 mol/L CH3COOH��Һ��5 mL 0.2 mol/L NaOH��Һ��ϣ�c��Na+��=c��CH3COO-����c��OH-����c��H+�� | |
| D�� | 10 mL 0.5 mol/L CH3COONa��Һ��6 mL 1 mol/L�����ϣ�c��Cl-����c��Na+����c��OH-����c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com