
【题目】己二酸是合成尼龙-66的主要原料之一。实验室合成己二酸的原理、有关数据如下:
3![]() +8HNO3→3
+8HNO3→3![]() +8NO↑+7H2O
+8NO↑+7H2O
物质 | 相对分子质量 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
环己醇 | 100 | 0.962 g/cm3 | 25.9℃ | 160.8℃ | 20℃时,在水中溶解度为3.6g,可混溶于乙醇、苯 |
己二酸 | 146 | 1.360 g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g。易溶于乙醇,不溶于苯 |
步骤Ⅰ:在如图装置的三颈烧瓶中加入16 mL 50%的硝酸(过量,密度为1.310 g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。

步骤Ⅱ:水浴加热三颈烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
步骤Ⅲ:当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10 min(注意控制温度),直至无红棕色气体生成为止。
步骤Ⅳ:趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后抽滤、洗涤、干燥、称重。请回答下列问题:
(1)装置b的名称为__________,使用时要从_________(填“上口”或“下口”)通入冷水;滴液漏斗的细支管a的作用是________________。
(2)实验中,先将温度由室温升至50℃左右,再慢慢控制在60℃~65℃之间,最后控制在80℃~90℃,目的是____________________。
(3)本实验所用的50%的硝酸物质的量浓度为____________;实验中,氮氧化物废气(主要成分为NO和NO2)可以用NaOH溶液来吸收,其主要反应为NO+NO2+2NaOH == 2NaNO2+H2O。其中NaOH溶液可以用Na2CO3溶液来替代,请模仿上述反应,写出Na2CO3溶液吸收的方程式:______________________________________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水或______洗涤晶体。
(5)通过称量得到产物7.00 g,则本实验产率为__________(精确到0.1%)。
【答案】球形冷凝管 下口 平衡滴液漏斗与三口烧瓶内的气压,使环己醇能够顺利流下 减少硝酸的分解 10.4mol·L-1 2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO+NO2+2Na2CO3=2NaNO2+CO2 苯 92.3%
【解析】
(1)仪器b为球形冷凝管;采取逆流原理通入冷凝水,使冷凝管中充满冷凝水,使挥发的有机物进行冷凝回流,提高原料利用率;平衡滴液漏斗与圆底烧瓶内压强,便于液体顺利流下;
(2)根据c= ![]() ,计算该硝酸的物质的量浓度;将氢氧化钠替换为碳酸钠、水替换为二氧化碳即可;
,计算该硝酸的物质的量浓度;将氢氧化钠替换为碳酸钠、水替换为二氧化碳即可;
(3)根据c=![]() 计算50%的硝酸(密度为1.31g·cm-3)的物质的量浓度;Na2CO3溶液吸收的两个方程式:2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO+NO2+2Na2CO3=2NaNO2+CO2;
计算50%的硝酸(密度为1.31g·cm-3)的物质的量浓度;Na2CO3溶液吸收的两个方程式:2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO+NO2+2Na2CO3=2NaNO2+CO2;
(4)己二酸不溶于苯,而环己醇易溶于苯,要减小因洗涤导致的损失,可以用苯洗涤。
(5)5.4 mL环己醇,密度为0.962 g/cm3,n(环己醇)= ![]() =0.0519mol,理论上产生己二酸的质量为:0.0519mol×146g·mol-1=7.58g,通过称量得到产物7.00 g,据此计算本实验产率。
=0.0519mol,理论上产生己二酸的质量为:0.0519mol×146g·mol-1=7.58g,通过称量得到产物7.00 g,据此计算本实验产率。
(1)该仪器有球形结构,仪器b为球形冷凝管;采取逆流原理通入冷凝水,使冷凝管中充满冷凝水,使挥发的有机物进行冷凝回流,提高原料利用率,即从冷凝管的下口通入,从上口流出;滴液漏斗的细支管a的作用是:平衡滴液漏斗与三口烧瓶内的气压,使环己醇能够顺利流下;
(2)实验中,先将温度由室温升至50℃左右,再慢慢控制在60℃~65℃之间,最后控制在80℃~90℃,有利于反应的进行,并提高反应速率,但温度过高,硝酸要分解,影响产率,即目的是:减少硝酸的分解;
(3)根据c=![]() ,可知50%的硝酸(密度为1.31g·cm-3)的物质的量浓度为
,可知50%的硝酸(密度为1.31g·cm-3)的物质的量浓度为![]() mol·L-1=10.4mol·L-1;Na2CO3溶液吸收的两个方程式:2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO+NO2+2Na2CO3=2NaNO2+CO2;
mol·L-1=10.4mol·L-1;Na2CO3溶液吸收的两个方程式:2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO+NO2+2Na2CO3=2NaNO2+CO2;
(4)产品己二酸中含有环己醇、硝酸等杂质,己二酸在水中的溶解度:15℃时1.44g,25℃时2.3g,温度高溶解度大,可用冰水洗涤,除去环己醇、硝酸,己二酸不溶于苯,最后用苯洗涤晶体,除去表面的杂质,避免产品损失;
(5)5.4 mL环己醇,密度为0.962 g/cm3,n(环己醇)= ![]() =0.0519mol,理论上产生己二酸的质量为:0.0519mol146g·mol-1=7.58g,,通过称量得到产物7.00 g,则本实验产率为
=0.0519mol,理论上产生己二酸的质量为:0.0519mol146g·mol-1=7.58g,,通过称量得到产物7.00 g,则本实验产率为![]() ×100%=92.3%。
×100%=92.3%。


科目:高中化学 来源: 题型:
【题目】已知:①1mol晶体硅中含有2molSi—Si键。
②Si(s)+O2(g)===SiO2(g) ΔH,其反应过程与能量变化如图所示。
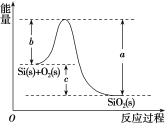
③
化学键 | Si—O | O=O | Si—Si |
断开1 mol共价键所需能量/kJ | 460 | 500 | 176 |
下列说法中正确的是( )
A.晶体硅光伏发电是将化学能转化为电能B.二氧化硅稳定性小于硅的稳定性
C.ΔH=-988kJ·mol-1D.ΔH=(a-c)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝是科技、生产、生活中应用最广泛的金属材料。

现有铁、铝的混合物进行如下实验:

(1)操作X的名称是_____。
(2)气体A是_____。
(3)A与Cl2混合光照可能发生爆炸,生成_____(填化学式),A在该反应中作为_____(填“氧化剂”或“还原剂”)。
(4)溶液B中阴离子除OH-外还有_____,溶液D中存在的金属离子为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学一选修3:物质结构与性质)
氧化亚铜(Cu2O)可用于陶瓷、固体整流器。可用反应制备:2(CuSO4·5H2O) ![]() Cu2O+SO2↑+SO3↑+O2↑+10H2O。回答下列问题:
Cu2O+SO2↑+SO3↑+O2↑+10H2O。回答下列问题:
(1)Cu2O中基态铜的离子的价层电子排布图为_______________。在高温下CuO能分解生成Cu2O,试从原子结构角度解释其原因__________________。
(2)已知H2SO4的结构式如图所示: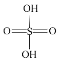 。上述反应中:
。上述反应中:
①在上述产物中,VSEPR模型与硫酸相同的是_________(填化学式,下同),与NO3-互为等电子体的一种分子是________。
②SO32-的杂化类型是________,请比较键角的大小:SO32-_____SO42-(填“>”“<”或“=”)
(3)CuCl2与氨水反应可形成配合物[Cu(NH3)4]Cl2,1mol该配合物中含有σ键的数目为____________。
(4)四方晶系CuFeS2晶胞结构如图所示。已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是________gcm3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是短周期元素,原子半径:D>C>A>B。已知A、B同周期,A、C同主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的3倍。请回答下列问题:
(1)A元素在周期表中的位置:____;B、D两元素形成化合物的化学式:_________。
(2)元素B、C、D的简单离子半径的大小顺序:____________(用离子符号回答)。
(3)C、D两元素最高价氧化物对应水化物的碱性强弱关系: > (用化学式表示)。________
(4)B、C形成的化合物在D元素最高价氧化物对应水化物的溶液中反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18;A原子核内仅有1个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D原子有两个电子层,最外层电子数是次外层电子数的3倍;E元素的最外层电子数是其电子层数的三分之一。
(1)试推断它们各是什么元素,写出它们的元素符号:
A______、B______、C.______、D______、E______。
(2)写出A分别与B、C、D所形成化合物的化学式:_________、_________、_________。
(3)A、C、D形成的化合物与A、D、E形成的化合物各属于那类物质?__________写出它们相互反应的化学方程式。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是

A. 盐酸的浓度越大,腐蚀速率越快
B. 钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C. 碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
D. 对比盐酸和硫酸两条曲线,可知Cl—也会影响碳素钢的腐蚀速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,为心血管疾病的临床药物。其合成路线(部分反应条件略去) 如下所示:
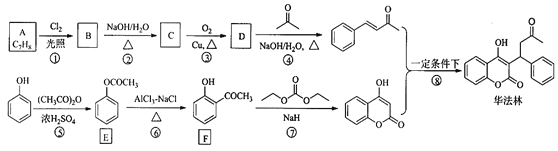
回答下列问题:
(1)A 的名称为________,E 中官能团名称为________。
(2)B 的结构简式为________。
(3)由 C 生成 D 的化学方程式为___________
(4)⑤的反应类型为_________,⑧的反应类型为________。
(5)F 的同分异构体中,同时符合下列条件的同分异构体共有___________种。
a.能与 FeCl3 溶液发生显色反应 b.含有-CHO
其中核磁共振氢谱为五组峰的结构简式为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在TiCl3的饱溶液中通入HCl至饱和,再加入乙醚生成绿色晶体,如果不加入乙醚,直接通入HCl得到的是紫色晶体,已知两种晶体分子式均为TiCl3·6H2O,配位数都是6的配合物,分别取0.01mol两种晶体在水溶液中用过量AgNO3处理,绿色晶体得到的白色沉淀质量为紫色晶体得到沉淀质量的![]() ,则下列有关说法不正确的是( )
,则下列有关说法不正确的是( )
A.该绿色晶体配体是氯离子和水,它们物质的量之比为1:5
B.紫色晶体配合物的化学式为[Ti(H2O)6]Cl3
C.上述两种晶体的分子式相同,但结构不同,所以性质不同
D.0.01mol紫色晶体在水溶液中与过量AgNO3作用最多可得到2.78g沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com