
| A. | c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH) | B. | c(CH3COO-)=c(Cl-)>c(CH3COOH)=c(H+) | ||
| C. | c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | D. | c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
分析 将0.2mol/LCH3COONa与0.1mol/L盐酸等体积混合后,溶液显酸性得到等浓度的CH3COONa和CH3COOH的混合溶液,醋酸电离大于醋酸根离子的水解,据此分析.
解答 解:将0.2mol/LCH3COONa与0.1mol/L盐酸等体积混合后,溶液显酸性得到等浓度的CH3COONa、CH3COOH和NaCl的混合溶液,醋酸电离大于醋酸根离子的水解,溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-),
故选D.
点评 本题考查了电解质溶液中离子浓度大小、反应后溶液酸碱性判断和微粒浓度大小比较,主要是醋酸电离和醋酸根离子水解程度的大小分析判断,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
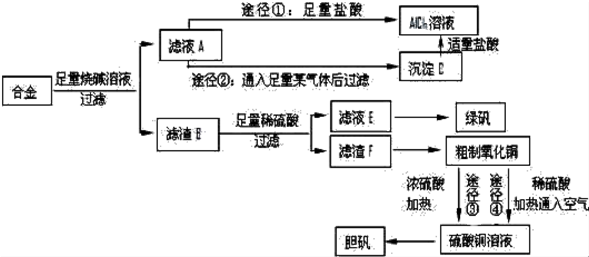
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验目的 | 温度 | 废水样品 | 2.0mLH2C2O4的浓度 |
| ① | 为以下实验作参照 | 273K | 4.0mL | 0.10mol?L-1 |
| ② | 298K | 4.0mL | 0.10mol?L-1 | |
| ③ | 探究浓度对反应速率的影响 | 273K | 0.20mol?L-1 |
| 实验方案(不要求写具体操作过程) | 预期的实验现象和结论 |
| 取等量的废水样品于两支试管中,… |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
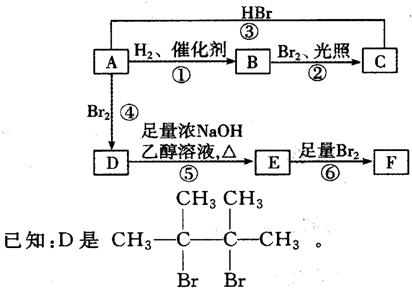
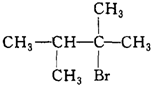 .
. ;;写出由E-F的化学方程式
;;写出由E-F的化学方程式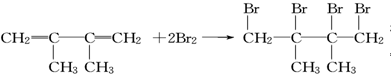 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
.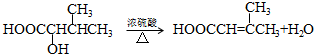 .
. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com