
【题目】铝电池性能优越,Al-Ag2O2电池用于电解尿素[CO(NH2)2]的碱性溶液制备氢气(隔膜Ⅱ仅阻止气体通过,a、b均为惰性电极).下列说法正确的是
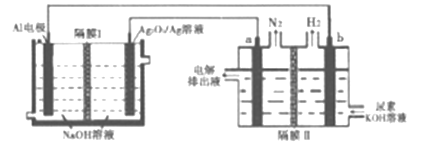
A. Ag电极是正极,反应后该电极区溶液pH减小
B. 原电池的总反应为:2Al+3Ag2O2+2NaOH=2NaAlO2+3Ag2O+H2O
C. a电极上的电极反应为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
D. 每消耗2.7g铝,理论上a、b两极共产生气体3.36L(标准状况)
【答案】C
【解析】A、铝比银活泼,铝作负极,银作正极,正极反应式为2H2O+2e-=H2↑+2OH-,该电极区pH增大,故A错误;B、电池总反应式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故B错误;C、a连接Ag,a作阳极,根据示意图,此电极上产生氮气,因此尿素在a极上放电,电解质为碱性,C转化成CO32-,电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,故C正确;D、Al电极反应式为Al+4OH--3e-=AlO2-+2H2O,消耗2.7gAl,整个电路转移电子物质的量为2.7×3/27mol=0.3mol,a极上产生N2的物质的量为0.3/6mol=0.05mol,b极反应式为2H++2e-=H2↑,产生氢气的物质的量为0.3/2mol=0.15mol,即产生气体体积为(0.15+0.05)×22.4L=4.48L,故D错误。


科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
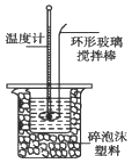
(1)写出该反应的热化学方程式(中和热为57.3 kJ/mol): 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H= (取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是: (填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种。下列根据实验事实得出的结论正确的是
A. 取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3
B. 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3
C. 取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl
D. 称取3.80g固体,加热至恒重,质量减少了0.620g。用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
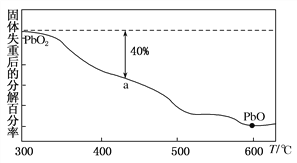
【题目】已知铅元素有+2价、+4价两种常用价态,铅及其化合物可用于耐酸设备及X射线防护等。
(1)我国古代炼丹中经常使用到红丹(用X表示),在一定条件下,与过量硝酸能发生非氧化还原反应:X+4HNO3===PbO2+2Pb(NO3)2+2H2O(已配平)。
①PbO2中铅元素的化合价是________,PbO2不是碱性氧化物,判断的依据是_________________________________________________。
②X的化学式是________。
(2)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为____________________________________________。
(3)PbO2在加热的过程中发生分解生成PbO和O2,其失重曲线如图所示,已知失重曲线上的a点为样品分解40%的残留固体。若a点固体组成表示为PbOx,则x=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. ![]() 的溶液中:Na+、K+、AlO2-、NO3-
的溶液中:Na+、K+、AlO2-、NO3-
B. 含有大量Fe3+的溶液中:NH4+、I-、Cl-、K+
C. pH=7的溶液中:NH4+、Al3+、SO42-、NO3-
D. 0.1mol·L-1Na2SO3的溶液中:H+、Ca2+、Fe2+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达到平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应的焓变为正值
B.恒温下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2O![]() CO2+H2
CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是利用一种微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜。下列说法中正确的是

A. 铜电极应与X相连接
B. H+经过质子交换膜由右向左移动
C. 当N电极消耗0. 25 mol气体时,则铁电极增重16 g
D. M电极反应式:CO(NH2)2+H2O-6e- =CO2↑+N2↑+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻;C与E同主族;A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个; F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红。
(1)E在周期表中的位置为____________________;B2F4的电子式_________________。
(2)B的最高价氧化物的水化物与其氢化物反应生成Z,则Z的名称为_______________,Z的化学键类型为____________________。
(3)可以比较C和E得电子能力强弱的是___________________(填写编号) 。
a.比较这两种元素最高正价的大小
b.二者形成的化合物中,D 元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(4)两种均含C、D、E、F四种元素的化合物相互反应放出气体的反应离子方程式为_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com