
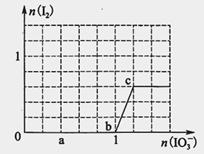
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,试回答下列问题:
(1)写出a点反应的离子方程式________________;反应中还原剂是______________;被还原的元素是__。
(2)写出b点到c点反应的离子方程式_____________________________。
(3)若往100 mL 1 mol·L-1的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为__________。
【知识点】氧化还原反应原理的应用 离子方程式书写 B2 B3 B1
【答案解析】(1)3HSO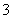 +IO
+IO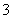 ===3SO
===3SO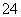 +I-+3H+ (2分)
+I-+3H+ (2分)
NaHSO3 (1分) 碘元素 (1分)
(2)5I-+IO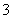 +6H+===3I2+3H2O (2分)
+6H+===3I2+3H2O (2分)
(3)2IO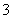 +5HSO
+5HSO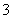 ===I2+5SO
===I2+5SO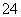 +3H++H2O(2分)
+3H++H2O(2分)
解析:根据还原性HSO-3>I-,向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,按照顺序先发生:2IO3-+6HSO3-═2I-+6SO42-+6H+,继续加入KIO3,由于氧化性IO-3>I2,再发生:IO3-+6H++5I-=3H2O+3I2,
(1)由图可知,a点没有生成碘,故发生反应2IO3-+6HSO3-═2I-+6SO42-+6H+,反应中S元素化合价升高,还原剂是HSO3-,I元素的化合价降低,I元素被还原;
(2)由图可知,b点到c点由于生成I2,故发生反应:IO3-+6H++5I-=3H2O+3I2;
(3)向100mL 1mol/L的KIO3溶液中滴加NaHSO3溶液,HSO3-被氧化为SO42-,KIO3过量,由于氧化性IO-3>I2,KIO3将氧化为I-,反应不能生成I-,而是生成I2,反应离子方程式为:2IO3-+5HSO3-=I2+5SO42-+3H++H2O。
【思路点拨】本题考查了氧化还原反应原理的应用,考查角度广,难度较大,理解氧化性及还原性顺序是关键。


科目:高中化学 来源: 题型:
工业上制取硫酸铜不是直接用浓硫酸与铜反应,而是将铜丝浸入稀硫酸中并不断地从容器下部吹入细小的空气泡,这样做的优点是
( )。
①节省能源 ②不产生污染大气的SO2 ③提高了H2SO4的利用率 ④提高了Cu的利用率
A.①② B.③④ C.①②③ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、S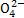 、Br-、C
、Br-、C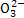 、HC
、HC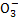 等离子,火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
等离子,火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
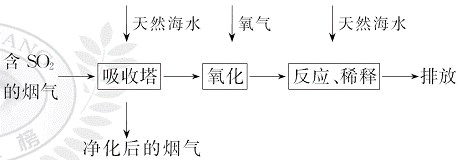
下列说法错误的是( )
A.天然海水pH≈8的原因是海水中的C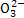 、HC
、HC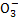 水解
水解
B.“氧化”是利用氧气将HS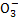 、S
、S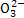 等氧化生成S
等氧化生成S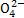
C.“反应、稀释”时加天然海水的目的是中和、稀释经氧气氧化后海水中生成的酸
D.“排放”出来的海水中S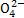 的物质的量浓度与进入吸收塔的天然海水相同
的物质的量浓度与进入吸收塔的天然海水相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A. 铝溶于NaOH溶液:Al+2OH—=AlO2—+H2↑
B. 铜溶于稀硝酸:3Cu+ 8H+ +2NO3—=3Cu2+ +2NO↑ + 4H2O
C. 碳酸镁中滴加稀盐酸:CO32—+2H+ =CO2↑ + H2O
D. 稀硫酸中滴加氢氧化钡溶液:H++ OH—=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+4H2O
C.磁性氧化铁溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:
2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示化学反应的离子方程式,其中正确的是
A.NaAlO2溶液中滴加过量盐酸:AlO2-+H2O+H+= AI(OH)3
B.氯气通入冷水中:Cl2+H2O 2H++Cl- +ClO-
2H++Cl- +ClO-
C.苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O =2C6H5OH +CO32-
D.FeCl3溶液与Cu反应:2Fe3++Cu = 2Fe2++ Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定溶液中能大量共存的是
A.常温下,c(H+)/c(OH-)=1×10-12的溶液:K+、AlO2-、CO32-、Na+
B.某溶液中可能大量存在:Fe3+、K+、HCO3-、SO42-
C.使pH试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl-
D.酸性溶液中:K+、Al3+、I-、ClO-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X含有Ba2+、Al3+、NH 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO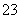 、SO
、SO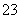 、SO
、SO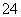 、Cl-、NO
、Cl-、NO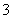 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:
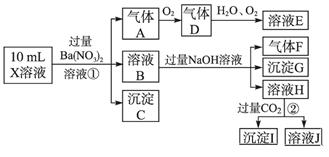
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是_____________________________________;
(2)写出有关离子方程式:
步骤①中生成A__________________;步骤②生成沉淀I__________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,不属于同分异构体的是( )
A.乙苯和二甲苯
B.CH2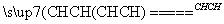 CH2和CH3CCCH3
CH2和CH3CCCH3
C.CH3CH2CH3和CH3(CH2)3CH3
D.CH3CH2OH和CH3OCH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com