
| A. | 0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.3NA | |
| B. | 3.4g NH3中含原子总数目为0.6NA | |
| C. | 新制的含NA个Fe(OH)3分子的氢氧化铁胶体中,含有胶粒的物质的量为1mol | |
| D. | 23gNO2和N2O4的混合气体中含有原子总数1.5NA |
分析 A.铁与盐酸反应后变为+2价;
B.求出氨气的物质的量,然后根据1mol氨气中含4mol原子来分析;
C.胶粒是一定数目粒子的集合体;
D.NO2和N2O4的最简式均为NO2.
解答 解:A.铁与盐酸反应后变为+2价,故0.1mol铁与盐酸反应后失去0.2mol电子即0.2NA个,故A错误;
B.3.4g氨气的物质的量n=$\frac{3.4g}{17g/mol}$=0.2mol,而1mol氨气中含4mol原子,故0.2mol氨气中含0.8mol原子即0.8NA个,故B错误;
C.胶粒是一定数目粒子的集合体,含1mol氢氧化铁的胶体中,胶粒数目小于NA,故C错误;
D.NO2和N2O4的最简式均为NO2,故23g混合物中含有的NO2的物质的量n=$\frac{23g}{46g/mol}$=0.5mol,而1molNO2中含3mol原子,故0.5molNO2中含1.5mol即1.5NA个原子,故D正确;
故选D.
点评 本题考查阿伏伽德罗常数的计算与判断,题目难度中等,涉及知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力,注意熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{{K}_{w}}{c(O{H}^{-})}$=0.1mol•L-1的溶液:Na+、K+、SiO32-、NO3- | |
| B. | 遇苯酚显紫色的溶液:I-、K+、SCN-、Mg2+ | |
| C. | 与铝反应产生大量氢气的溶液:NH4+、Na+、CO32-、NO3- | |
| D. | 加入NaOH后加热既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含等物质的量的Al3+、NH4+的溶液中,逐滴加入NaOH溶液:Al3+、NH4+ | |
| B. | 含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| C. | 含等物质的量的Fe3+、Cu2+的溶液中,加入铁粉:Cu2+、Fe3+ | |
| D. | 含等物质的量的CH3COO-、ClO-溶液中,逐滴加入稀盐酸:CH3COO-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前使用的元素周期表中,最长的周期含有36种元素 | |
| B. | 只有在原子中,质子数才与核外电子数相等 | |
| C. | 金属元素与非金属元素能形成共价化合物 | |
| D. | 非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
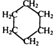 可用键线式表示为
可用键线式表示为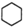 ,
,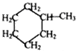 可用键线式表示为
可用键线式表示为 ;
;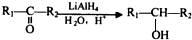 ;
;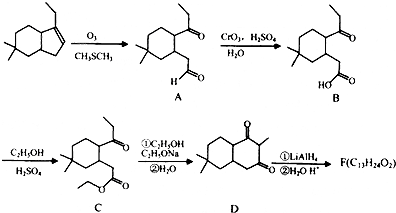
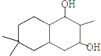 ;
;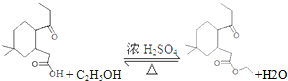 ;
;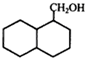 结构
结构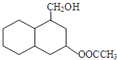 .
.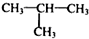 制
制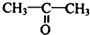 的流程图并注明反应条件.
的流程图并注明反应条件.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:4 | C. | 1:5 | D. | 1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(ClO)2(aq)$\stackrel{CO_{2}}{→}$HClO(aq)$\stackrel{光照}{→}$HCl(aq) | |
| B. | NaCl(饱和)$\stackrel{NH_{3}、CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | Al2O3$\stackrel{NaOH(aq)}{→}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| D. | NaAlO2(aq)$\stackrel{过量盐酸}{→}$AlCl3$\stackrel{电解}{→}$Al |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com