
【题目】将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A. 反应剧烈程度,两者相同
B. 消耗硝酸的物质的量:前者多,后者少
C. 反应生成气体的颜色:前者浅,后者深
D. 反应中转移的电子总数:前者多,后者少
科目:高中化学 来源: 题型:
【题目】生活中处处有化学,下列叙述正确的是
A.人的皮肤在强紫外线的照射下不会失去生理活性
B.常用新制的氢氧化铜检验司机酒后驾车
C.棉花和木材的主要成分都是纤维素
D.蜂蚁叮咬人的皮肤时将分泌物甲酸注入人体,此时可在患处涂抹食醋缓解不适
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)N2O4(g)(无色),如图所示. 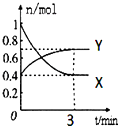
(1)曲线(填“X”或“Y”)表示NO2的物质的量随时间的变化曲线.
(2)若降低温度,则v(正) , v(逆) . (填“加快”或“减 慢”或“不变”).
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=0.3mol/(Ls),乙中v(N2O4)=6mol/(Lmin),则中反应更快.
(4)在0到3min中内N2O4的反应速率为 .
(5)下列叙述能说明该反应已达到化学平衡状态的是(填标号); A.v(NO2)=2v(N2O4)
B.容器内压强不再发生变化
C.X的体积分数不再发生变化
D.容器内气体原子总数不再发生变化
E.相同时间内消耗n mol的Y的同时生成2n mol的X
F.相同时间内消耗n mol的Y的同时消耗2n mol的X.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下将0.1mol N2和0.3mol H2置于密闭容器中发生反应:N2+3H2 ![]() 2NH3 . 下列关于该反应的说法正确的是( )
2NH3 . 下列关于该反应的说法正确的是( )
A.最终可生成0.2 mol NH3
B.增大压强能使反应速率减小
C.降低反应体系的温度能加快反应速率
D.向容器中再加入N2 , 能加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的量变化如图所示. 请解答下列问题: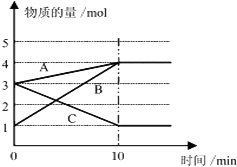
(1)反应的化学方程式用A,B,C可表示为 .
(2)用B的浓度变化表示在0~10min内的反应速率是 .
(3)在该条件达到反应的限度(平衡状态)时反应物的转化率(转化率═转化的物质的量/初始物质的量×100%,计算结果保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A. Al2O3熔点高,可用作耐高温材料
B. SO2具有氧化性,可用于漂白纸浆
C. SiO2硬度大,可用于制造光导纤维
D. NH3易溶于水,可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,可形成氢氧燃料电池.通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种.试回答下列问题: 
(1)酸式电池的电极反应:负极 , 正极;电池总反应:;电解质溶液pH的变化(填“变大”“变小”或“不变”).
(2)碱式电池的电极反应:负极 , 正极;电池总反应:;电解质溶液pH的变化(填“变大”“变小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.氯碱工业中电解饱和食盐水:2Cl﹣+2H2O ![]() H2↑+Cl2↑+2OH﹣
H2↑+Cl2↑+2OH﹣
B.氯化铁溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+
C.氢氧化钠溶液吸收少量二氧化硫SO2+OH﹣=HSO3﹣
D.稀硫酸中加氢氧化钡溶液至中性:Ba2++H++OH﹣+SO42﹣=BaSO4↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com