
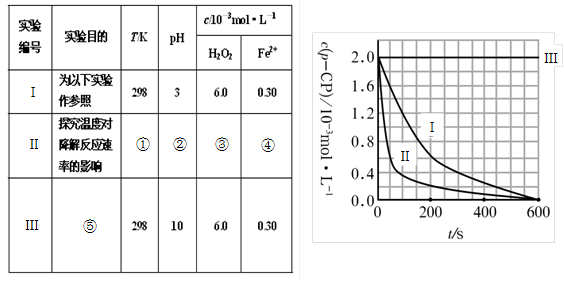
(16分)Fenton法常用于处理含难降解有机物的工业废水。通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,试探究有关因素对该降解反应速率的影响。实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表)设计如下对比实验。
(1)请完成以下实验设计表(将表中序号处应填内容)。
① ② ③ ④
⑤
(2)实验测得p-CP的浓度随时间变化的关系如右上图所示。
a.请根据右上图实验Ⅰ曲线,计算降解反应在50—300s内的平均反应速率v(p-CP)= ,以及300s时p-CP的降解率为 ;
b.实验Ⅰ、Ⅱ表明温度升高,降解反应速率 (填“增大”、“减小”或“不变”);
c.实验Ⅲ得出的结论是:pH=10时, ;
(3)可通过反应Fe3++ SCN— Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)=0.04 mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(16分)纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(1)制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,该水解反应的化学方程式为 。再经过滤、水洗除去其中的Cl–,再烘干、焙烧除去水分得到粉体TiO2 。检验TiO2·xH2O中Cl–是否被除净的方法是 。
(2)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是 ;
②滴定终点的现象是 。
③滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为 。
④下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果 。
若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果 。
查看答案和解析>>
科目:高中化学 来源:2012届山东济宁汶上一中高三12月月考化学试卷 题型:填空题
(16分)Fenton法常用于处理含难降解有机物的工业废水。通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,试探究有关因素对该降解反应速率的影响。实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表)设计如下对比实验。
(1)请完成以下实验设计表(将表中序号处应填内容)。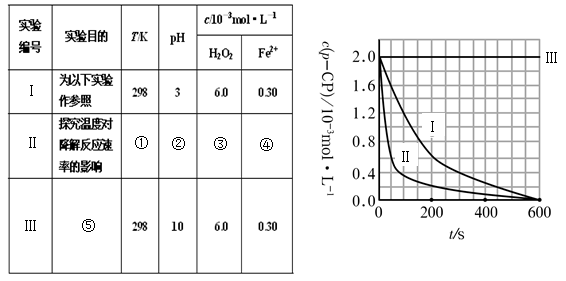
① ② ③ ④
⑤
(2)实验测得p-CP的浓度随时间变化的关系如右上图所示。
a.请根据右上图实验Ⅰ曲线,计算降解反应在50—300s内的平均反应速率v(p-CP)= ,以及300s时p-CP的降解率为 ;
b.实验Ⅰ、Ⅱ表明温度升高,降解反应速率 (填“增大”、“减小”或“不变”);
c.实验Ⅲ得出的结论是:pH=10时, ;
(3)可通过反应Fe3+ + SCN— Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试理综化学部分(福建卷带解析) 题型:填空题
(16分)
(1)电镀时,镀件与电源的 极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层。
① 若用铜盐进行化学镀铜,应选用_(填“氧化剂”或“还原剂”)与之反应。
② 某化学镀铜的反应速率随镀液pH 变化如右图所示。该镀铜过程中,镀液pH 控制在12.5左右。据图中信息,给出使反应停止的方法: 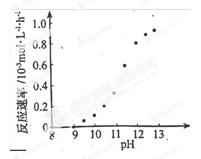
(3)酸浸法制取硫酸铜的流程示意图如下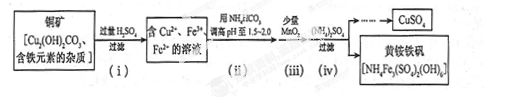
① 步骤(i)中Cu2(OH) 2CO3发生反应的化学方程式为 。
② 步骤(ii)所加试剂起调节pH 作用的离子是 (填离子符号)。
③ 在步骤(iii)发生的反应中,1 mol MnO2转移2 mol 电子,该反应的离子方程式为 。
④ 步骤(iv)除去杂质的化学方程式可表示为
3Fe3+ + NH4++2SO42-+6H2O= NH4Fe3 (SO4)2(OH)6+6H +
过滤后母液的pH =" 2.0" , c (Fe3+) ="a" mol·L-1,, c ( NH4+)="b" mol·L-1,, c ( SO42-)=" d" mol·L-1,该反应的平衡常数K=_ (用含a 、b 、d 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东济宁汶上一中高三12月月考化学试卷 题型:填空题
(16分)Fenton法常用于处理含难降解有机物的工业废水。通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,试探究有关因素对该降解反应速率的影响。实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表)设计如下对比实验。
(1)请完成以下实验设计表(将表中序号处应填内容)。
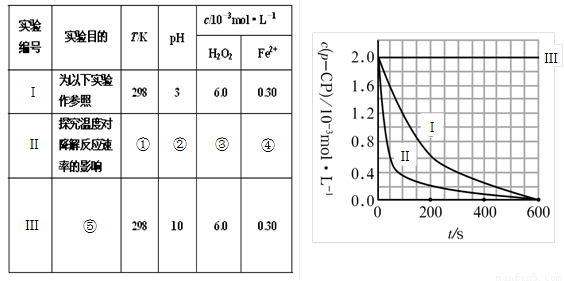
① ② ③ ④
⑤
(2)实验测得p-CP的浓度随时间变化的关系如右上图所示。
a.请根据右上图实验Ⅰ曲线,计算降解反应在50—300s内的平均反应速率v(p-CP)= ,以及300s时p-CP的降解率为 ;
b.实验Ⅰ、Ⅱ表明温度升高,降解反应速率 (填“增大”、“减小”或“不变”);
c.实验Ⅲ得出的结论是:pH=10时, ;
(3)可通过反应Fe3+
+ SCN—  Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)=0.04 mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)=0.04 mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com