
【题目】下列有关实验装置的说法不正确的是

A.装置①中酸性高锰酸钾溶液中出现气泡,且颜色逐渐褪去
B.利用②中仪器可以配置75%的酒精溶液
C.装置③可用于实验室制备CO2气体
D.装置④可用来测定未知浓度的稀盐酸
【答案】D
【解析】
A.浓硫酸使蔗糖脱水后,C与浓硫酸反应生成二氧化硫;
B.量筒可量取酒精与水的体积;
C.碳酸钙为块状固体,与盐酸反应生成二氧化碳;
D.图中为碱滴定酸,NaOH与二氧化硅反应生成具有粘合性的硅酸钠。
A.浓硫酸具有脱水性和强的氧化性,可以使蔗糖脱水后反应产生C单质,C与浓硫酸反应生成二氧化硫,二氧化硫与高锰酸钾溶液发生氧化还原反应,则酸性高锰酸钾溶液中出现气泡,且颜色逐渐褪去,A正确;
B.量筒可量取酒精与水的体积,可配制75%的酒精溶液,B正确;
C.碳酸钙为块状固体,与盐酸反应生成二氧化碳,可用于实验室制备CO2气体,C正确;
D.图中为碱滴定酸,NaOH与二氧化硅反应生成具有粘合性的硅酸钠,滴定管应选碱式滴定管,D错误;
故合理选项是D。


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,生成物所贮的化学能比反应物所贮化学能要多的是( )
A.CaO+H2O=Ca(OH)2
B.NaOH+HCl=NaCl+H2O
C.CH4+2O2 ![]() CO2+2H2O
CO2+2H2O
D.CO2+C ![]() 2CO
2CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ某无土栽培用的营养液,营养液要求KCl、K2SO4和NH4Cl 3种固体原料的物质的量之比为1:4:8。
(1) 配制该营养液后c(NH4+)=0.016 mol﹒L-1,溶液c(K+)=_______________。
(2) 若采用(NH4)2SO4和KCl来配制该营养液,则(NH4)2SO4和KCl物质的量之比为________
Ⅱ从1L 1 mol﹒L-1氢氧化钠溶液中取出100 mL:
(1)取出的这100 mL氢氧化钠溶液的物质的量浓度是______。若将取出的这100 mL氢氧化钠溶液加水稀释至500 mL,所得溶液的物质的量浓度是_____。
某学生计划用12 mol﹒L-1的浓盐酸配制0.1 mol﹒L-1的稀盐酸450 mL,回答下列问题:
(2)实验过程中,不必使用的是________(填字母)。
A.托盘天平 B.量筒 C.容量瓶 D.250 mL烧杯E.胶头滴管F.500 mL试剂瓶
(3)除上述仪器可使用外,还缺少的仪器是________。
(4)量取浓盐酸的体积为___ mL,应选用的量筒规格为______(提供10.0 mL、25.0 mL)。
(5)配制时应选用的容量瓶规格为______________。
(6)某同学操作出现以下情况,对所配溶液浓度将有何影响(填“偏高”“偏低”或“无影响”)。
定容时俯视刻度线__________加蒸馏水时不慎超过了刻度__________,此时应如何处理 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是A、B、C、D四种常见有机物的相关信息。
有机物A | 有机物B | 有机物C | 有机物D |
①可用于果实催熟 ②比例模型为 | ①由C、H两种元素组成 ②球棍模型为 | ①生活中常见的液态有机物,分子中碳原子数与有机物A相同, ②能与Na反应,但不能与NaOH反应 | ①相对分子质量比有机物C大14 ②能由有机物C氧化生成 |
根据表中信息回答下列问题:
(1)有机物A的分子式为________。
(2)下列有关有机物A、B的说法正确的是________(填字母)。
a.A、B均可使酸性KMnO4溶液褪色
b.A、B分子中所有的原子在同一平面内
c.等质量的A、B完全燃烧,消耗氧气的量相同
d.A、B分子均含有碳碳双键,能发生加成反应
(3)写出有机物C的同分异构体的结构简式:________。
(4)在一定条件下,有机物C与有机物D反应能生成具有水果香味的物质E,其化学反应方程式为_______,某次实验中,以5.0gD为原料,制得4.4gE,则D的转化率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求计算。
(1)0.5mol NaAlO2含有___mol Na+;_____mol AlO2-;含___个O。
(2)在100 mL 0.2 mol/L NaOH溶液中含溶质的物质的量___mol;配制50 mL 0.2 mol/LFeSO4溶液,需要FeSO4____ g。
(3)1.06 g的Na2CO3的物质的量是___mol;含有的CO32-离子数是___个。
(4)标准状况下,0.3 mol CH4的体积是___;含有碳原子质量是___;含有氢原子物质的量_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:

下列说法中错误的是( )
A. ①②中除加试剂外,还需要进行过滤操作
B. a、b中铝元素的化合价相同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空:
(1)由CH4和O2组成的混合气体在标准状况下的密度为l g·L-1,则该混合气体中CH4和O2的体积比为________。
(2)用98%(密度为1.84g/mL )的浓硫酸配制500mL 2.5mol/L的稀硫酸,需用量筒量取浓硫酸的体积为________mL。
(3)向100mL 0.2mol/L 的NaAlO2溶液与300mL 0.1mol/L的HCl溶液混合,反应的离子方程式: _________________。
(4)某混合溶液中仅含有离子:Fe2+、Cl-、Br-、I-,测得Cl-、Br-、I-的物质的量之比为2:3:4,往溶液中通入一定量的氯气,充分反应后溶液中Cl-和Br-的物质的量之比为3:1,则通入的氯气的物质的量与溶液中剩余Fe2+的物质的量之比为=_________________。(假设溶液的体积在反应前后不变)
(5)酸性条件下,向FeI2的淀粉溶液中加入H2O2溶液后变蓝。当有1mol Fe2+被氧化成Fe3+时,转移电子4mol。写出该反应的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体化合物X由四种常见的元素组成,为探究其成分,某学生进行如下实验:

①20.8gX固体进行实验,得到白色粉末1质量12.0g,白色粉末2质量为6.0g;
②白色粉末2可用作耐高温材料,白色粉末3是一种常见干燥剂;请回答问题:
(1)X中金属元素的名称是______。
(2)化合物X与足量盐酸反应离子方程式______。
(3)在高温条件下,白色粉末2中某元素单质与白色粉末1反应,是工业制备另一种单质方法之一,写出该反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
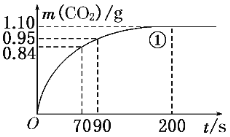
【题目】某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响;(Ⅱ)实验①和③探究温度对反应速率的影响;(Ⅲ)实验①和④探究________对反应速率的影响 |
② | 25 | 粗颗粒 | _______ | |
③ | _______ | 粗颗粒 | 2.00 | |
④ | _________ | 细颗粒 | ______ |
(2)实验①中CO2质量随时间变化的关系见下图。计算实验①中70 s~90 s范围内用HNO3表示的平均反应速率________(忽略溶液体积变化,不需要写出计算过程)。在O~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com