
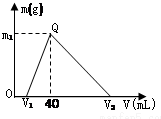
 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200mL c(OH-)=0.1mol/L的溶液,然后逐滴加入1mol/L的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如图所示,则下列说法正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200mL c(OH-)=0.1mol/L的溶液,然后逐滴加入1mol/L的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如图所示,则下列说法正确的是( )| A、原合金质量为 0.92 g |
| B、图中V2为 100 |
| C、整个加入盐酸过程中 Na+的浓度保持不变 |
| D、Q点m1为0.78 |
| 0.02mol |
| 1mol/L |


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
| A、CO2的水溶液能导电,所以CO2是电解质 |
| B、BaSO4不溶于水,其水溶液很难导电,所以BaSO4是非电解质 |
| C、液氯不导电,所以液氯是非电解质 |
| D、氯化氢的水溶液能导电,所以氯化氢是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol SO2和1mol O2在一定条件下反应,反应后分子总数大于2NA |
| B、25℃,在pH=2的1.0L H2SO4溶液中含有H+数目为0.01NA |
| C、在二氧化硅的晶体中,1mol SiO2含有Si-O键数目为NA |
| D、25mL 18mol?L-1浓硫酸与足量Zn反应,转移电子数为0.225NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、前20 min的平均反应速率v(C)=0.1 mol/(L?min) |
| B、A的转化率为50% |
| C、C的平衡浓度c(C)=4 mol/L |
| D、B的平衡浓度c(B)=1.5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量浓度和体积都相同的盐酸和醋酸溶液,在与足量锌反应时,起始时二者产生H2速率基本相等 |
| B、100 mL 1 mol?L-1的盐酸和50 mL 2 mol?L-1的盐酸,分别与足量的锌反应时,两者放出H2速率和质量均相等 |
| C、100 mL pH=3的H2SO4和HCl溶液,与足量锌反应后,放出H2的质量相等 |
| D、100 mL pH=3的盐酸与醋酸溶液,与足量锌反应后,所得H2的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 +R
+R| 一定条件 |
| 反应① |
 +R
+R| 一定条件 |
| 反应② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 空气污染指数 | 0~50 | 51~100 | 101~150 | 151~200 | 201~250 | 251~300 | >300 |
| 空气质量状况 | 优 | 良 | 轻度污染 I | 轻度污染 II | 中度污染 I | 中度污染 II | 重度污染 |
| 空气质量级别 | I | II | III | III | IV | IV | V |
| 城市 | 首要污染物 | 空气污染指数 | 空气质量级别 |
| 上海 | 可吸入颗粒物 | 111 | Ⅲ轻度污染I |
| 淄博 | 可吸入颗粒物 | 103 | ? |
| 昆明 | 二氧化硫 | 61 | Ⅱ良 |
| 海口 | -- | 24 | Ⅰ优 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com