
【题目】已知土壤胶体胶粒带负电荷,又有很大的表面积,因而具有选择吸附能力,在土壤里施用含氮量相同的下列肥料,肥效较差的是
A. (NH4)2SO4 B. NH4HCO3 C. NH4NO3 D. NH4Cl
科目:高中化学 来源: 题型:
【题目】某同学在实验报告中有以下实验数据:①用托盘天平称取11.7 g食盐;②用量筒量取5.26 mL盐酸;③用广泛pH试纸测得溶液的pH值是3.5,其中数据合理的是 ( )
A. ① B. ②③ C. ①③ D. ②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.常温常压下,8 g O2含有4NA个电子
B.1 L 0.1 molL﹣1的氨水中有NA个NH4+
C.标准状况下,22.4 L盐酸含有NA个HCl分子
D.1 mol Na被完全氧化生成Na2O2 , 失去2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列实验各装置图的叙述,不正确的是( ) 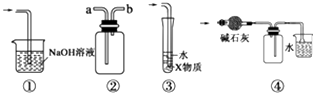
A.装置①可用于吸收实验中多余的Cl2
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2等
C.装置③中X为苯,可用于吸收氨气或氯化氢
D.装置④中可用于收集氨气,并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 可用过滤的方法将悬浊液中的分散质从分散剂中分离出来
B. 任何物质在水中都有一定的溶解度
C. 同一种溶质的饱和溶液要比不饱和溶液的浓度大
D. 布朗运动是胶体粒子特有的运动方式,只用肉眼就可以把胶体、溶液和浊液区别开
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A元素原子的L电子层比B元素原子的L电子层少3个电子,B元素原子核外总电子数比A 元素原子电子总数多5个,则A、B形成化合物可能是
A. 离子化合物ABB. 离子化合物B3A2
C. 离子化合物B2(AO3)3D. 离子化合物A2BO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图1所示装置可以完成一系列实验(图中夹持装置已略去). 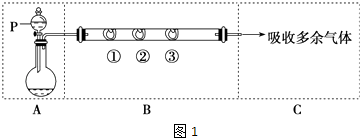
用装置A由浓硫酸和浓盐酸混合制取HCl气体,装置B中的三处棉花依次做了如下处理:①包有某固体物质,②蘸有KI溶液,③蘸有石蕊溶液.
请回答下列问题:
(1)仪器P的名称是;
(2)①处包有的某固体物质可能是(填序号); a.MnO2 b.KMnO4 c.KCl d.Cu
反应开始后,观察到②处有棕黄色物质产生,在实验过程中,在③处能观察到;
(3)甲同学为了验证剩余气体的主要成分,在C中设计了如图2装置,D中装有铜丝网,装置E的试管中不加任何试剂,装置F的烧杯中加入适量的AgNO3溶液 ①实验过程中,装置D的作用是
②装置F中的现象是;
③乙同学认为甲同学的实验有缺陷,为了确保实验的可靠性,乙同学提出在和(填装置字母)之间加装如图3所示装置.你认为如图3广口瓶中可加入足量(填字母代号),此试剂的作用是 . 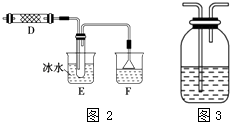
A.淀粉﹣碘化钾溶液 B.四氯化碳溶液 C.湿润的有色布条 D.饱和食盐水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.
(1)根据题意解答 (i)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈,与盐酸反应的速度最慢;与盐酸反应产生的气体最多.
(ii)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为 .
(2)利用如图装置可验证同主族元素非金属性的变化规律: 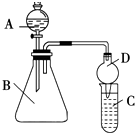
(i)仪器B的名称为 , 干燥管D的作用为 .
(ii)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液的现象,即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液吸收尾气.
(iii)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液的现象,即可证明.但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有溶液的洗气瓶除去.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一化学反应中,其产物的总能量为80kJ,如果该反应是放热反应,那么反应物的总能量可能是( )
A.100KJ
B.60KJ
C.50KJ
D.30KJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com