

| 16 |
| x+16 |
| 16 |
| x+16 |
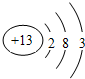 ;
; ;第四周期第VIII族;
;第四周期第VIII族;
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、一定温度下,弱酸的电离常数越大,酸性越强 |
| B、醋酸的电离常数K.和醋酸钠的水解常数之间的关系为:Ka?Kh=Kw |
| C、平衡常数只受温度影响,与反应物或生成物的浓度变化无关 |
| D、合成氨的反应,正反应的平衡常数和逆反应的平衡常数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:

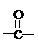 的异构体的数目有
的异构体的数目有查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 茶是我国人民喜爱的饮品,其中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素.某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
茶是我国人民喜爱的饮品,其中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素.某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)查看答案和解析>>
科目:高中化学 来源: 题型:
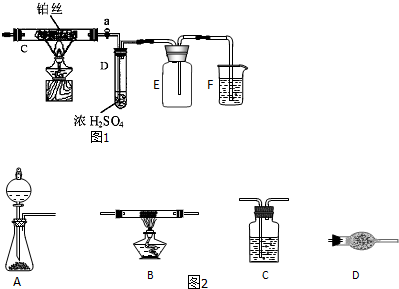
查看答案和解析>>
科目:高中化学 来源: 题型:
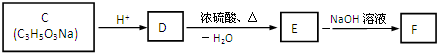
查看答案和解析>>
科目:高中化学 来源: 题型:
 金属是一种重要的材料,人类的生活和生产都离不开金属.如图表示了金属活动性顺序表中的铜、锡、铁和铝元素被人类大规模开发、利用的大致年限.
金属是一种重要的材料,人类的生活和生产都离不开金属.如图表示了金属活动性顺序表中的铜、锡、铁和铝元素被人类大规模开发、利用的大致年限.查看答案和解析>>
科目:高中化学 来源: 题型:
 ,下列有关其性质的叙述正确的是( )
,下列有关其性质的叙述正确的是( )| A、1,4-二氧杂环乙烷与丁酸互为同分异构体 |
| B、1,4-二氧杂环乙烷与乙酸乙酯互为同系物 |
| C、1,4-二氧杂环乙烷与钠反应可放出氢气 |
| D、1,4-二氧杂环乙烷的分子中所有原子不可能共平面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com