
【题目】在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
(1)写出基态E原子的价电子排布式 .
(2)B、C、D三元素第一电离能由小到大的顺序为(用元素符号表 示) ;A与C形成CA3型分子,分子中C原子的杂化类型为 ,分子的立体结构为 ;C的单质与 BD化合物是等电子体,据等电子体的原理,写出BD化合物的电子式 ; A2D由液态形成晶体时密度 (填增大,不变或减小),分析主要原因(用文字叙述)
(3)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为(用元素符号表示) ;若相邻D原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为 g/cm3(用含a、NA的符号表示).

【答案】(1)3d54s1;(2)C<O<N;sp3;三角锥形;![]() ;水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小;(3)Cu2O;
;水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小;(3)Cu2O;![]() .
.
【解析】在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,B的一种核素在考古时常用来鉴定一些文物的年代,则B为碳元素,D原子核外电子有8种不同的运动状态,则D为氧元素,C的氧化物是导致酸雨的主要物质之一,且C的原子序数小于D,所以C为氮元素,E的基态原子在前四周期元素的基态原子中单电子数最多,其原子外围电子排布式为1s22s22p63s23p63d54s1,则E为铬元素,F元素的基态原子最外能层只有一个电子,其它能层均已充满,则F原子外围电子排布为3d104s1,所以F为铜元素,A与其余五种元素既不同周期也不同主族,所以A为氢元素.
(1)E为铬元素,基态E原子的价电子排布为3d54s1,故答案为:3d54s1;
(2)C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:C<O<N;
A与C形成NH3分子,分子中N原子形成3个N﹣H、含有1对孤对电子,故N原子杂化类型为sp3,分子的立体结构为三角锥形;
C的单质为N2,化合物CO是等电子体,二者结构相似,CO分子中C原子与O原子之间形成三对共用电子对,故CO的电子式为![]() ;
;
H2O形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小,
(3)根据晶胞的结构图可知,晶胞中含有氧原子数为1+8×![]() =2,铜原子数为4,所以该化合物的化学式为Cu2O,晶胞质量为(4×
=2,铜原子数为4,所以该化合物的化学式为Cu2O,晶胞质量为(4×![]() +2×
+2×![]() )g,若相邻氧原子和铜原子间的距离为a cm,则晶胞的体对角线为4acm,所以边长为
)g,若相邻氧原子和铜原子间的距离为a cm,则晶胞的体对角线为4acm,所以边长为![]() cm,所以体积为(
cm,所以体积为(![]() cm)3cm3,该晶体的密度为(4×
cm)3cm3,该晶体的密度为(4×![]() +2×
+2×![]() )g÷(
)g÷(![]() cm)3=
cm)3=![]() g/cm3
g/cm3


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】鲨鱼是世界上惟一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性。已知鲨烯分子含有30个C原子及6个C=C且不含环状结构,则其分子式为( )
A. C30H48 B. C30H62 C. C30H60 D. C30H50
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液,②39%的酒精溶液,③氯化钠和单质溴的水溶液.分离以上各混合液的正确方法依次是( )
A.过滤、萃取、分液
B.萃取、分液、蒸馏
C.分液、蒸馏、萃取
D.萃取、蒸馏、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积为5L的恒容密闭容器内,充入0.2molCO和0.4molH2O,在一定条件下发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH>0。反应中CO2的浓度(c)随时间(t)的变化关系如图所示。
CO2(g)+H2(g) ΔH>0。反应中CO2的浓度(c)随时间(t)的变化关系如图所示。
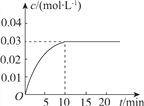
回答下列问题:
(1)下列叙述能判断该反应达到平衡状态的是________(填序号)。
①H2O的质量不再变化
②混合气体的总压强不再变化
③CO、H2O、CO2、H2的浓度都相等
④单位时间内生成amolCO,同时生成amolH2
(2)0~10min时段,反应速率v(H2)=________;反应达到平衡时,c(H2O)=________,CO的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW.该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是:
A. a = b
B. 混合溶液的pH = 7
C. 混合溶液中,c(H+) =![]() mol/L
mol/L
D. 混合溶液中,c(H+) + c(B+) = c(OH-) + c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol/LNa2CO3溶液加适量水稀释,下列各项随着加水量的增大而减小的是
A. n(OH-) B. 溶液的pH C. n(H+)·c(OH-) D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①离子化合物可能含有共价键 ②构成分子的微粒一定含有共价键 ③共价化合物中不可能含有离子键 ④非极性分子中一定含有非极性键
A. ①②B. ①③C. ②④D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于钠的叙述中,正确的是( )
A.钠是银白色金属,硬度很大
B.将金属钠放在石棉网上,用酒精灯加热后金属钠剧烈燃烧,发出黄色火焰,生成过氧化钠
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过二硫酸钠(Na2S2O8)具有强氧化性,在印染、造纸和医学等方面应用广泛。利用电解制备过二硫酸钠的装置如图(a、b 均为惰性电极):下列说法正确的是

A. 过二硫酸钠中的硫呈+7价
B. 电极a是电解池的阴极
C. 电极a的电极反应式为:2SO42-+2e-=S2O82-
D. 所用离子交换膜为阴离子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com