
| A. | 室温下,1L pH=1的硫酸溶液中,含有H+的数目为0.1NA | |
| B. | 22.4L HCl和22.4L DCl中 所含质子数均为18NA | |
| C. | 2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA | |
| D. | 1 mol C3H6分子中碳碳共价键数为2NA |
分析 A、pH=1的硫酸溶液中氢离子的浓度为0.1mol/L;
B、气体所处的状态不明确;
C、二氧化硫和氧气的反应为可逆反应;
D、C3H6可能是丙烯,也可能是环丙烷.
解答 解:A、pH=1的硫酸溶液中氢离子的浓度为0.1mol/L,故1L溶液中的氢离子的物质的量为0.1mol,个数为0.1NA个,故A正确;
B、气体所处的状态不明确,故气体的物质的量无法计算,则含有的质子数也无法计算,故B错误;
C、二氧化硫和氧气的反应为可逆反应,故2mol二氧化硫不能完全转化为三氧化硫,则转移的电子数小于4NA个,故C错误;
D、C3H6可能是丙烯,也可能是环丙烷.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乳酸薄荷醇酯(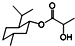 )不仅能发生氧化、消去反应,还能发生取代反应 )不仅能发生氧化、消去反应,还能发生取代反应 | |
| B. | 乙醛和丙烯醛( )不是同系物,它们与氢气充分反应后的产物也不是同系物 )不是同系物,它们与氢气充分反应后的产物也不是同系物 | |
| C. | 按系统命名法,化合物 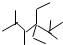 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| D. | 化合物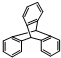 是苯的同系物 是苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| B. | 乙烯能发生加成反应,乙烷不能发生加成反应 | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 苯酚与浓溴水可直接反应,而苯与液溴反应则需要FeBr3作催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
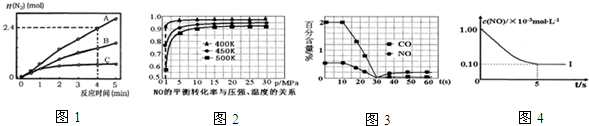
| 实验编号 | T(K) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表面积(m2/g) |
| Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
| Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
| Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
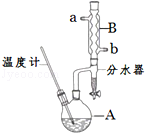 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:| 相对分子质量 | 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| T(℃) | 527 | 627 | 727 | 827 | 927 |
| 平衡常数K | 910 | 42 | 3.2 | 0.39 | 0.12 |
| A. | 根据平衡常数随温度的变化关系,判断出△H<0 | |
| B. | 保持其他条件不变,SO2的平衡转化率α(727℃)<α(927℃) | |
| C. | 增大压强、降低温度能提高SO2的转化率 | |
| D. | SO3的稳定性随温度的升高而降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向浓氨水中滴加饱和FeCl3溶液,可以制得Fe(OH)3胶体 | |
| B. | 为除去Mg(OH)2固体中少量Ca(OH)2,可用饱和MgCl2溶液多次洗涤后,再水洗、干燥 | |
| C. | 向溶液X中加入足量盐酸,产生无色无味气体,将气体通入澄清石灰水,产生白色沉淀,说明溶液X中含有CO32- | |
| D. | 卤代烃Y与NaOH醇溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀,说明卤代烃Y中含有氯原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com