
【题目】为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
(1)①把含有较高浓度CO2的空气通入饱和K2CO3溶液。②在①的吸收液中通高温水蒸气得到高浓度的CO2气体。请写出②中反应的化学方程式______。
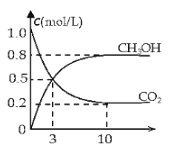
(2)如将CO2与H2以1:3的体积比混合,在适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
从反应开始到平衡,v(H2)=______;氢气的转化率=______;能使平衡体系中n(CH3OH)增大的措施有______。(只写一种即可)
【答案】2KHCO3![]() K2CO3+H2O+CO2↑ 0.24mol/(L
K2CO3+H2O+CO2↑ 0.24mol/(L![]() min) 80% 降低温度(或加压或增大H2的量等)
min) 80% 降低温度(或加压或增大H2的量等)
【解析】
(1)①中碳酸钾吸收二氧化碳生成碳酸氢钾,通高温水蒸气,碳酸氢钾分解生成碳酸钾、二氧化碳与水;
(2)由图可知,10min达平衡,平衡时甲醇的浓度变化为0.8mol/L,根据![]() 计算v(CH3OH),再根据速率之比等于化学计量数之比计算v(H2);
计算v(CH3OH),再根据速率之比等于化学计量数之比计算v(H2);
根据CH3OH平衡浓度,利用n=cV计算△n(CH3OH),再根据方程式计算△n(H2),利用转化率等于计算氢气的转化率;
改变体积使平衡向正反应移动,可以增大CH3OH的物质的量,据此结合方程式特征解答。
(1)①中碳酸钾吸收二氧化碳生成碳酸氢钾,通高温水蒸气,碳酸氢钾分解生成碳酸钾、二氧化碳与水,反应方程式为:2KHCO3![]() K2CO3+H2O+CO2↑;
K2CO3+H2O+CO2↑;
故答案为:2KHCO3![]() K2CO3+H2O+CO2↑;
K2CO3+H2O+CO2↑;
(2)由图可知,10min达平衡,平衡时甲醇的浓度变化为0.8mol/L,则10分钟内,v(CH3OH)=0.08mol/(L![]() min),根据速率之比等于化学计量数之比,故v(H2)=3 v(CH3OH)=3×0.08mol/(Lmin)=0.24mol/(L
min),根据速率之比等于化学计量数之比,故v(H2)=3 v(CH3OH)=3×0.08mol/(Lmin)=0.24mol/(L![]() min),平衡时△n(CH3OH)=0.8mol/L×2L=1.6mol,根据方程式可知△n (H2)=3△n(CH3OH)=3×1.6mol=4.8mol,所以氢气的转化率为
min),平衡时△n(CH3OH)=0.8mol/L×2L=1.6mol,根据方程式可知△n (H2)=3△n(CH3OH)=3×1.6mol=4.8mol,所以氢气的转化率为![]() ×100%=80%;
×100%=80%;
该反应正反应是体积减小的放热反应,故降低温度或加压或增大H2的量等,可以是平衡向正反应移动,增大CH3OH的物质的量;
故答案为:0.24mol/(L![]() min);80%;降低温度(或加压或增大H2的量等)。
min);80%;降低温度(或加压或增大H2的量等)。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】现将下列物质分别装入有水的锥形瓶里(见下图),立即塞紧带 U 形管的塞子, 发现 U 形管内滴有红墨水的水面如图所示状态,判断加入的物质不可能是( )
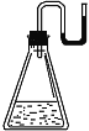
A.NaOH 固体B.浓硫酸C.![]() 晶体D.CaO固体
晶体D.CaO固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废水中可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、CO32-、S2-、SO32-、SO42-。现取该溶液进行有关实验,实验过程及现象如图所示:

下列说法不正确的是
A.根据实验①中的现象可推出,淡黄色沉淀一定不是AgBr
B.根据实验②中的现象可推出,气体B是CO2,沉淀B是Al(OH)3,原溶液中一定含有AlO2-
C.根据实验③中的现象可推出,气体C是NH3,沉淀C一定有BaCO3,可能有BaSO4
D.原溶液中肯定含有Na+、AlO2-、S2-,不能确定是否含有SO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS-、S2-)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。下列说法不正确的是

A.含硫物种B表示HS-
B.在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系:c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
C.X,Y为曲线的两交叉点,若能知道X点处的pH,就可以计算出H2S的Ka值
D.NaHS呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是Cu2++HS-===CuS↓+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L密闭容器中通入amol气体A和bmol气体B,在一定条件下发生反应:xA(g)+yB(g) ![]() pC(g)+qD(g)已知:平均反应速率v(C)=
pC(g)+qD(g)已知:平均反应速率v(C)=![]() v(A);反应2min时,A的浓度减少了
v(A);反应2min时,A的浓度减少了![]() ,B的物质的量减少了
,B的物质的量减少了![]() mol,有
mol,有![]() molD生成。回答下列问题:
molD生成。回答下列问题:
(1)反应2min内,v(A)=______________;v(B)=______________;
(2)下列叙述能说明该反应已达平衡状态的是:______;
A、 xV(A)正=qV(D)逆 B、气体总的质量保持不变 C、C的总质量保持不变 D、混合气体总的物质的量不再变化 E、混合气体总的密度不再变化 F、混合气体平均分子量不再变化
(3)反应平衡时,D为2amol,则B的转化率为________;
(4)其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较,反应速率_____(是“增大”“减小”或“不变”),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl36H2O能否反应产生Cl2.资料:FeCl3是一种共价化合物,熔点306℃,沸点315℃。
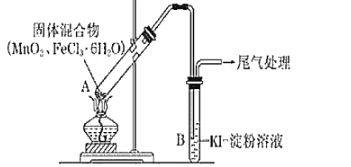
ⅰ.实验操作和现象:

ⅱ.分析现象的成因:
(1)现象i中的白雾是______,用化学方程式和必要的文字说明白雾的形成原因是______。
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.直接加热FeCl36H2O,产生白雾和黄色气体。
b.将现象ii和a中的黄色气体通入KSCN溶液,溶液均变红。
通过该实验说明现象ii中黄色气体含有______。
(3)除了氯气可使B中溶液变蓝外,该小组还提出其他两种可能的原因:
可能原因①:实验b检出的气体使之变蓝;反应的离子方程式是______。
可能原因②:______;反应的离子方程式是______。
(4)为进一步确认黄色气体中是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。

①方案1的C中盛放的试剂是______,从化学平衡原理的角度加以解释______。
②方案2中检验Fe2+的最佳试剂是______,若存在Fe2+,则现象是______。
③综合方案1、2的现象,说明方案2中选择NaBr溶液的依据是______。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《科学美国人》评出的2016年十大创新技术之一是碳呼吸电池,电池原理如图所示,则下列有关说法正确的是
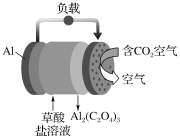
A.以此电池为电源电解精炼铜,当有0.1 mol 电子转移时,有3.2 g铜溶解
B.正极每消耗4.48L的CO2,则生成0.1molC2O42-
C.每生成1 mol Al2(C2O4)3,有6 mol电子流过草酸盐溶液
D.随着反应进行,草酸盐浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备![]() 纳米颗粒的反应是
纳米颗粒的反应是![]() ,关于该反应下列说法中正确的是( )
,关于该反应下列说法中正确的是( )
A.H2O和S4O62-都是还原产物B.![]() 和
和![]() 都是还原剂
都是还原剂
C.![]() 被氧化时,转移
被氧化时,转移![]() 电子D.
电子D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学画出的基态氮原子核外电子排布图。下列判断正确的是( )
![]()
A. 正确,符合核外电子排布规律B. 错误,违背了“能量最低原理”
C. 错误,违背了“泡利原理”D. 错误,违背了“洪特规则”
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com