
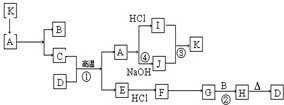
 如图每一方框表示有关反应的某一反应物或生成物,有关操作已略去.又知A为高熔点物质,可做耐火材料,A在一定条件下可生成B和C,B为无色气体,D为一种天然出产的矿石的主要成分,可作为颜料.
如图每一方框表示有关反应的某一反应物或生成物,有关操作已略去.又知A为高熔点物质,可做耐火材料,A在一定条件下可生成B和C,B为无色气体,D为一种天然出产的矿石的主要成分,可作为颜料. 2Fe+Al2O3,
2Fe+Al2O3, 2Fe+Al2O3;4Fe(OH)2+O2+H2O=4Fe(OH)3;
2Fe+Al2O3;4Fe(OH)2+O2+H2O=4Fe(OH)3;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
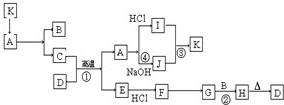 如图每一方框表示有关反应的某一反应物或生成物,有关操作已略去.又知A为高熔点物质,可做耐火材料,A在一定条件下可生成B和C,B为无色气体,D为一种天然出产的矿石的主要成分,可作为颜料.
如图每一方框表示有关反应的某一反应物或生成物,有关操作已略去.又知A为高熔点物质,可做耐火材料,A在一定条件下可生成B和C,B为无色气体,D为一种天然出产的矿石的主要成分,可作为颜料.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:黄冈重点作业 高三化学(下) 题型:022
| |||||||||||||||
查看答案和解析>>
科目:高中化学 来源:黄冈重点作业 高三化学(下) 题型:022
| |||||||||||||||
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山西省阳泉十五中高一(上)月考化学试卷(12月份)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com