
【题目】下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明.已知A、D为金属单质,其他为化合物.(B是黑色物质,是一种矿石的主要成分)
试推断:
(1)A的原子结构示意图为 , 写出B的化学式: , 写出C的化学式: , 主要成分是J的矿石的名称: .
(2)在反应F→E中,要使F中的一种金属元素全部以沉淀的形式析出,最适宜加入的反应物是 , D通过化合反应转化为G应加入的反应物为 , F和E两溶液混合后的现象是 .
(3)写出下列反应的方程式:H→I的化学方程式 , C→F的离子方程式 , F→E的离子方程式 ,
(4)鉴定G溶液中所含阳离子的方法是 .
【答案】
(1)![]() ;Fe3O4;Al2O3;赤铁矿
;Fe3O4;Al2O3;赤铁矿
(2)CO2;可溶性铁盐(如FeCl3);产生白色沉淀
(3)4Fe(OH)2+O2+2H2O═4Fe(OH)3;2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑;2AlO2﹣+4H+═Al3++2H2O
(4)滴加少量KSCN溶液,溶液不变红,再滴加氯水若溶液变红,则说明原液含Fe2+
【解析】解:A、D是常见的金属单质,是一种矿石的主要成分,化合物I是红褐色沉淀,结合转化关系可知,B是Fe3O4、I为Fe(OH)3 , H是Fe(OH)2 , J为Fe2O3 , 则A是Al,D为Fe、C为Al2O3 , ①是强酸,②是强碱(因为Al2O3溶于强碱),E中含Al3+ , G中含Fe2+ , F为偏铝酸盐.(1)A为Al,原子结构示意图为 ![]() ,B的化学式:Fe3O4 , C的化学式:Al2O3 , 主要成分是Fe2O3的矿石的名称:赤铁矿, 所以答案是:
,B的化学式:Fe3O4 , C的化学式:Al2O3 , 主要成分是Fe2O3的矿石的名称:赤铁矿, 所以答案是: ![]() ;Fe3O4;Al2O3;赤铁矿;
;Fe3O4;Al2O3;赤铁矿;
由上述分析可知,A为Al,B为Fe2O3 , G为FeCl2 , (2)在反应偏铝酸盐→Al3+中,要使偏铝酸盐中的一种金属元素全部以沉淀的形式析出,最适宜加入的反应物是CO2 , D通过化合反应转化为G应加入的反应物为:可溶性铁盐(如FeCl3),偏铝酸盐和铝盐两溶液混合后的现象是:产生白色沉淀,
所以答案是:CO2;可溶性铁盐(如FeCl3);产生白色沉淀;(3)H→I的化学方程式:4Fe(OH)2+O2+2H2O═4Fe(OH)3 ,
C→F的离子方程式:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑,
F→E的离子方程式:2AlO2﹣+4H+═Al3++2H2O,
所以答案是:4Fe(OH)2+O2+2H2O═4Fe(OH)3;2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑;2AlO2﹣+4H+═Al3++2H2O;(4)G溶液中含有Fe2+ , 所含阳离子检验方法是:滴加少量KSCN溶液,溶液不变红,再滴加氯水若溶液变红,则说明原液含Fe2+ ,
所以答案是:滴加少量KSCN溶液,溶液不变红,再滴加氯水若溶液变红,则说明原液含Fe2+ .


科目:高中化学 来源: 题型:
【题目】难挥发性二硫化钽(TaS2)可采用如下装置提纯.将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中.反应如下:TaS2(s)+2I2(g)TaI4(g)+S2(g)下列说法正确的是( ) ![]()
A.在不同温度区域,TaI4的量保持不变
B.在提纯过程中,I2的量不断减少
C.在提纯过程中,I2的作用是将TaS2从高温区转移到低温区
D.该反应的平衡常数与TaI4和S2的浓度乘积成反比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。以下是氯元素形成物质的二维图的部分信息。
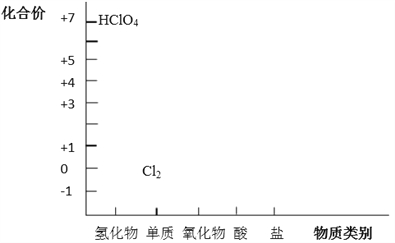
(1)根据图中信息,写出任意两种氯的氧化物的化学式_____________。
(2)写出高氯酸(HClO4)与NaOH反应的化学方程式__________。
(3)HCl既具有氧化性,又具有还原性。
①请任意写出一个体现HCl氧化性的离子方程式__________。
②浓HCl可作为还原剂在加热条件下与MnO2发生反应制备Cl2,写出该反应的化学方程式___________。
(4)Cl2既具有氧化性,又具有还原性,请结合上图说明原因_________。潮湿的Cl2与Na2CO3混合制取少量Cl2O的反应中,Cl2既体现了氧化性,也体现了还原性。写出反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用海水“晒盐”的方法得到的粗盐中,除氯化钠外,还含有氯化镁、氯化钙、硫酸钠等杂质。将此粗盐提纯的部分实验方案如下:
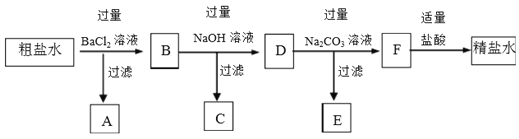
(1)粗盐水中含有的阳离子有_______,阴离子有__________。
(2)加入BaCl2溶液的目的是(用离子方程式表示)_________。
(3)生成沉淀C的离子方程式是______。
(4)D中所含离子有_______。
(5)E的主要成分的化学式是____。
(6)用文字描述加入适量盐酸的目的是________。
(7)某同学认为加入过量K2CO3溶液与加入过量Na2CO3溶液同样可以达到实验目的,这种说法是否合理,请说明理由______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体和溶液的叙述正确的是
A. 胶体为分散质粒子直径在10nm~100nm之间的分散系
B. 可利用过滤的方法分离胶体和溶液
C. 溶液是混合物,胶体是纯净物
D. 利用丁达尔效应可以区别胶体和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示。
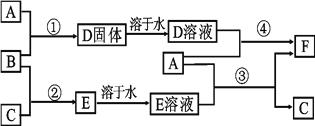
请回答:
(1)写出B物质的化学式:____;F的化学名称:____。
(2)写出第②步C在B中燃烧的反应现象:____。
(3)写出第④步反应的化学反应方程式____。
(4)F溶液中滴入NaOH溶液可能产生的实验现象是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Fe2O3(s)+ ![]() C(s)═
C(s)═ ![]() CO2(g)+2Fe(s)△H=+234.1kJ/mol
CO2(g)+2Fe(s)△H=+234.1kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
则:2Fe(s)+ ![]() O2(g)═Fe2O3(s)的△H是( )
O2(g)═Fe2O3(s)的△H是( )
A.﹣824.4 kJ/mol
B.﹣627.6 kJ/mol
C.﹣744.7 kJ/mol
D.﹣169.4 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)═2HCl (g)△H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=
(3)2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图1所示.已知1mol SO2(g)氧化为1mol SO3的△H=﹣99kJmol﹣1 . 请回答下列问题: 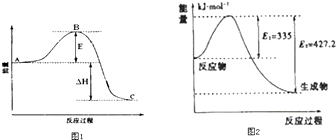
①图中△H=KJmol﹣1;
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,
(4)①如图2是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为: .
②若起始时向容器内放入1mol N2和3mol H2 , 达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为;若在同体积的容器中充入2mol N2和6mol H2 , 达平衡后放出的热量为Q2 kJ,则Q22Q1(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示]. 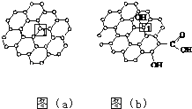
(1)图(a)中,1号C与相邻C形成σ键的个数为 .
(2)图(b)中,1号C的杂化方式是 , 该C与相邻C形成的键角(填“>”“<”或“=”)图(a)中1号C与相邻C形成的键角.
(3)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有(填元素符号).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com