
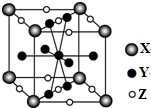
| A. | 1:1:1 | B. | 1:3:3 | C. | 4:4:5 | D. | 1:5:3 |
分析 顶点原子为8个晶胞共用,面上原子为2个晶胞共有,棱上原子为4个晶胞共用,体心原子为一个晶胞独有,利用均摊法计算晶胞中X、Y、Z微粒的个数,进而计算X、Y、Z微粒的个数比.
解答 解:顶点原子为8个晶胞共用,面上原子为2个晶胞共有,棱上原子为4个晶胞共用,体心原子为一个晶胞独有,则晶胞中X数目为8×$\frac{1}{8}$=1、Y数目为1+8×$\frac{1}{2}$=5、Z数目为8×$\frac{1}{4}$+2×$\frac{1}{2}$=3,晶体中X、Y、Z微粒的个数比为1:5:3,故选D.
点评 本题考查晶胞计算,注意利用均摊法计算解答,侧重考查学生对基础知识的巩固,明确每个原子被几个晶胞占有是解本题关键,题目难度不大.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热化学方程式的计量数可以表示分子的个数 | |
| B. | 热化学方程式中只需标明生成物的状态 | |
| C. | 反应热指的是反应过程中放出或吸收的热量 | |
| D. | 伴随能量变化的一定是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cu2++2 OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | H++OH-═H2O CH3COOH+NaOH═CH3COONa+H2O | |
| C. | Ag++Cl-═AgCl↓ AgNO3+HCl═AgCl↓+HNO3 | |
| D. | Ca2++HCO3-+OH-═CaCO3↓+H2O Ca(HCO3)2+Ca(OH)2═2CaCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银试液 | B. | 稀盐酸 | C. | 氢氧化钠试液 | D. | 酚酞试液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
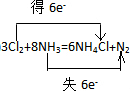
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光束通过胶体时有丁达尔效应 | B. | 胶体粒子带电荷 | ||
| C. | 胶体是一种介稳性的分散系 | D. | 胶体粒子直径在1-100nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
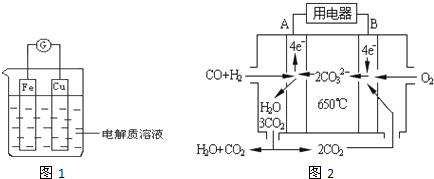
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com