
| A.通常状况下,氨的溶解度不大 | B.氨水中的NH3·H2O电离出少量的OH- |
| C.溶于水的氨分子只有少量电离 | D.氨本身的碱性弱 |
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a=b/3 | B.2a=b | C.a≥b | D.a<b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.二氧化硫具有漂白性,因而通入紫色石蕊试液中先变红后褪色 |
| B.浓硫酸和浓硝酸在常温下均可迅速与铜片反应放出气体 |
| C.浓硫酸与亚硫酸钠反应制备二氧化硫时,浓硫酸表现强氧化性 |
| D.稀硫酸和稀硝酸都具有氧化性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
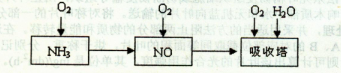
 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。| A.容器内N2、H2、NH3的浓度之比为l:3:2 |
B.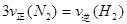 |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com